بتن مقاومت خوبی در برابر آتش دارد یعنی مدت زمانی که بتن در مقابل آتش به طور رضایت بخش عمل می نماید نسبتاً زیاد است و هیچگونه گاز سمی تولید نمی کند. معیارهای مربوط به عملکرد در مقابل آتش عبارتند از: ظرفیت تحمل بار، مقاومت در برابر نفوذ شعله و مقاومت در برابر انتقال حرارت وقتی که از بتن به عنوان ماده محافظ روی فولاد استفاده می شود. در مل آنچه که از بتن ساختمانی مورد نیاز است حفظ قدرت باربری در طول مدت معین می باشد.
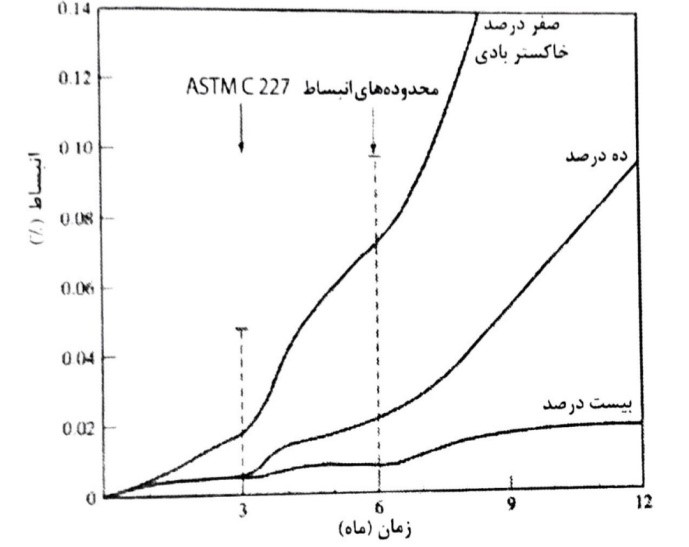
این عمل کاملاً متمایز از مقاوم بودن در برابر حرارت است. (شکل 8-11) رفتار بتن در دماهای بالا بستگی به عوامل چندی از جمله شرایط دما زایی، مساحت سطح بتن، طول مدت دمازایی، ترکیب بتن، میزان آب بتن، ساختمان منافذ سیمان و اندازه عضو سازه بتنی دارد. اضافه کردن افزودنی های معدنی به خصوص دوده سیلیسی ساختمان منافذ را در خمیر سیمان هیدراته بسیار ریز می کند. در نتیجه نرخ بخار شدن آب در خمیر سیمان می تواند کند شده و منجر به فشار داخلی در بتن و ایجاد آسیب گردد.
دراین مقاله که توسط کارشناسان کلینیک بتن ایران تهیه شده است، با تاثیر آتش و مواد شیمیایی بر بتن آشنا خواهید شد.
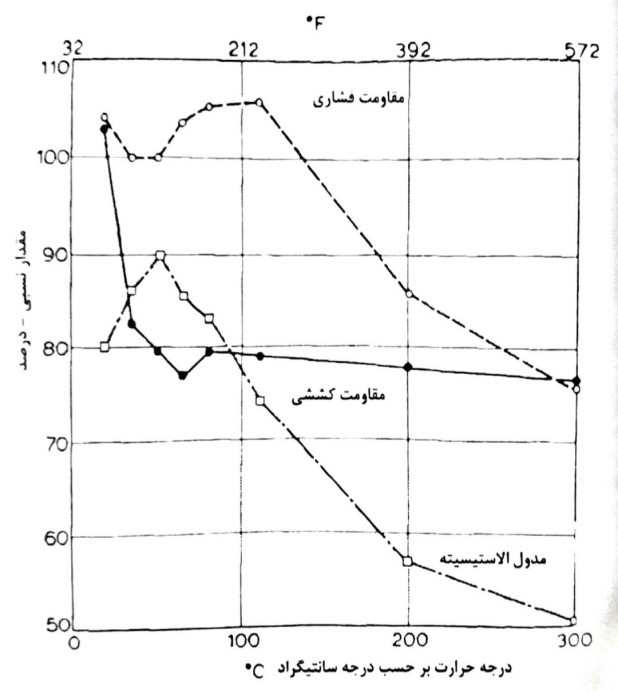 شکل 8-11- اثر حرارت بر مقاومت فشاری، کششی و مدول الاستیسیته بتن
شکل 8-11- اثر حرارت بر مقاومت فشاری، کششی و مدول الاستیسیته بتن
آسیب بتن در اثر حرارت ممکن است به صورت ترک خوردگی خود را نشان دهد و همچنین کاهش مقاومت گاهی به صورت ورقه ورقه شدن یا سطح خرد شدن به خصوص موقعی که در درصد آب بتن زیاد باشد از عوارض دیگر آن می باشد. در بتن سخت شده، آب به چند شکل وجود دارد: آب منافذ مویین (آب آزاد)، آب ژل یا زئولیتی (آب جذب شده) و آب وارد شده در ترکیب شیمیایی. براساس گزارش یکی از محققان، آب آزاد موجود در بتن در دمای 100 درجه سانتی گراد از بین می رود و آب جذب شده در دمای 180 درجه سانتیگراد شروع به تبخیر می کند و در آخر ترکیبات هیدراته شده در اجزاء شیمیایی C-S-H در حرارت حدود 700 درجه سانتی گراد شروع به تبخیر می کنند.
در دمای بالاتر پوسته پوسته شدن و خرد شدن بتن به علت کم شدن مقاومت خمیر سیمان و از هم پاشیدگی آن بر اثر تغییر شکل سنگدانه ها در اثر رارت و تنش های کششی زیاد در خمیر سیمان است. استفاده از مواد افزودنی معدنی برای بتن هایی که در معرض دما قرار می گیرند مطلوب نیست به ویژه در سازه های بتنی حجیم که بالا رفتن درجه حرارت باعث تغییراتی در سنگدانه ها شده و منتهی به تنش های کششی و ایجاد فشار داخلی زیادتر از تحمل بتن می شود.

آخرین مطالب تکمیلی کلینیک بتن ایران را در این بخش دنبال نمایید
رفتار بتن در برابر آتش
تاثیر میکروسیلیس در بتن در برابر آتش
تاثیر آتش بر خمیر سیمان
تاثیر افزایش دما بر روی خمیر سیمان هیدراته شده، بستگی به درجه هیدراتاسیون و حالت رطوبتی خمیر سیمان دارد. خمیر سیمان پرتلند خوب هیدراته شده، همانگونه که قبلاً توضیح داده شد دما بر روی خمیر سیمان هیدراته شده، بستگی به درجه هیدراتاسیون و حالت ��طوبتی خمیر سیمان دارد. خمیر سیمان پرتلند خوب هیدراته شده، همانگونه که قبلاً بیان شد، اساساً شامل سیلیکات کلسیم هیدراته، هیدروکسید کلسیم و سولفوآلومینات کلسیم هیدراته می باشد. خمیر سیمان اشباع شده دارای مقادیر زیادی آب آزاد و آب مویینه، اضافه بر آب جذب شده سطحی، می باشد. انواع مختلف آب، به سهولت با افزایش دمای بتن از دست می روند. با این وجود، از نقطه نظر محافظت در مقابل آتش می باید یادآوری کرد که به علت نیاز به حرارت تبخیر زیاد برای تبدیل آب به بخار تا هنگامی که تمام آب قابل تبخیر از بین نرفته است دمای بتن افزایش نخواهد یافت.
 تاثیر آتش بر خمیر سیمان
تاثیر آتش بر خمیر سیمان
وجود مقادیر زیادی از آب قابل تبخیر می تواند مشکل ساز شود. اگر سرعت گرم کردن زیاد و نفوذپذیری خمیر سیمان کم باشد، بتن ممکن است به صورت پکیدگی سطحی آسیب ببیند. پکیدن وقتی اتفاق می افتد که سرعت افزایش فشار گاز بخار داخل مصالح، بیش از سرعت کاهش فشار ناشی از آزاد شدن بخار به داخل جو باشد.
تا زمانی که دما به 300 درجه سانتی گراد می رسد، آب بین لایه ای C-S-H و نیز مقداری از آبی که به صورت شیمیایی ترکیب یافته و حاصل C-S-H و هیدرات های سولفوآلومینات است، از بین می رود. آب گیری بعدی خمیر سیمان به لت تجزیه هیدرواکسید کلسیم، در حدود دمای 500 درجه سانتی گراد آغاز می شود؛ اما برای تجزیه کامل C-S-H به دمایی در حدود 900 درجه سانتی گراد احتیاج است.
تاثیر آتش بر سنگدانه
مقاومت در برابر آتش و خواص حرارتی (ضریب رسانایی، ضریب پخش شوندگی و ضریب انبساط حرارتی) بتن به مقدار زیادی به مواد معدنی تشکیل دهنده سنگدانه های مصرفی بستگی درد. سنگدانه های سبک مصنوعی و برخی سنگدانه های سبک طبیعی به علت خواص عایق بندی و ثبات شان در حرارت بالا، نسبت به سنگدانه های معمولی از مقاومت بالاتری در برابر آتش برخوردارند. سنگدانه های سیلیسی حاوی کوارتز، مانند گرانیت و ماسه سنگ می توانند باعث بروز خطر در بتن در دمای حدود 573 درجه سانتی گراد شوند. در مورد سنگ های کربناتی خطر مشابهی می تواند در دمای بالای 700 درجه سانتی گراد در نتیجه واکنش کربنات زدایی آغاز گردد. علاوه بر انتقال احتمالی فاز و تجزیه حرارتی سنگدانه، پاسخ بتن به آتش، از سوی دیگر تحت تاثیر ترکیبات معدنی سنگدانه می باشد. برای مثال، شرایط کانی شناسی سنگدانه ها، تعیین کننده انبساط های حرارتی متفاوت بین سنگدانه و خمیر سیمان و نیز مقاومت نهایی ناحیه انتقال است.
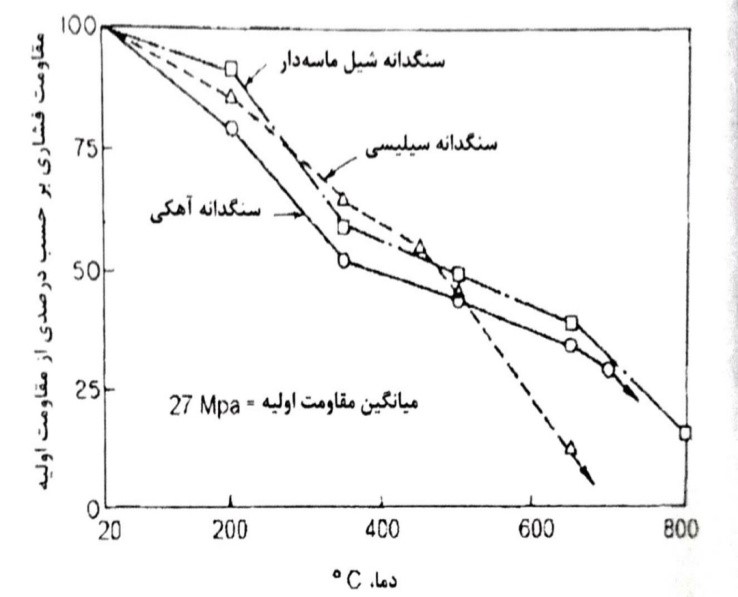
شکل 8-12- اثر دمای بالا بر مقاومت فشاری انواع سنگدانه ها
تخریب شیمیایی
واکنش هایی که منجر به تشکیل محصولات انبساط زا می شوند، مانند انبساط سولفات، انبساط ناشی از واکنش قلیایی سنگدانه ها و انبساط ناشی از خوردگی فولاد در بتن، تمایز بین علل فیزیکی و شیمیایی آسیب دیدگی بتن کاملاً اختیاری است. در عمل، این دو اغلب مکمل هم می شوند. مثلاً کاهش جرم ناشی از فرسودگی سطحی و ترک خوردگی، نفوذپذیری بتن را افزایش می دهد که این خود بعداً علت اصلی یک یا چند فرآیند آسیب دیدگی شیمیایی می شود. همین طور، پدیده های شیمیایی دارای تاثیرات فیزیکی هستند. برای مثال، نشتی آب شیرین یا مایعات اسیدی به درون اجزای خمیر سیمان سخت شده موجب افزایش تخلخل بتن شده و بنابراین مصالح را در برابر سایش و فرسایش، بیشتر آسیب پذیر می سازد.
 تاثیر آتش بر سنگدانه
تاثیر آتش بر سنگدانه
انتقال شیمیایی
اغلب، بتن شامل مویینگی است و در نتیجه انتقل شیمیایی تحت تاثیر عکس العمل بین آب حفره ای و مواد شیمیایی قرار می گیرد. اسیدها می توانند اجزای خمیر سیمان و بعضی سنگدانه ها را حل کنند و بنابراین به نفوذپذیری و ضریب انتشار می افزایند. بعضی مواد آلی، صابون های کلسیمی تشکیل می دهند که اثر کاهنده در نفوذپذیری دارند؛ اما بیشتر هیدروکربورها با بتن واکنش نمی دهند. برخی نمک های معدنی همچون کلریدهای سدیم و کلسیم ممکن است اثر فیزیکی بر بتن داشته و با تشدید اثر یخ زدن – آب شدن با اثر روی آرماتور سبب خوردگی شوند. بعضی دیگر با داشتن سولفات خطرات جدی به علت تهاجم شیمیایی خواهند داشت.
تاثیر میزان رطوبت در نفوذ یک مایع آلی در شکل (8-13) نشان داده شده است. در این حالت نفوذ بوتانل در بتن خشک حدود 2 تا 5/2 برابر نفوذ در بتن دارای 2 درصد وزنی خواهد بود. مقدار رطوبت مشخص کننده ماهیت و سرعت نفوذ هر ماده شیمیایی به داخل بتن است.
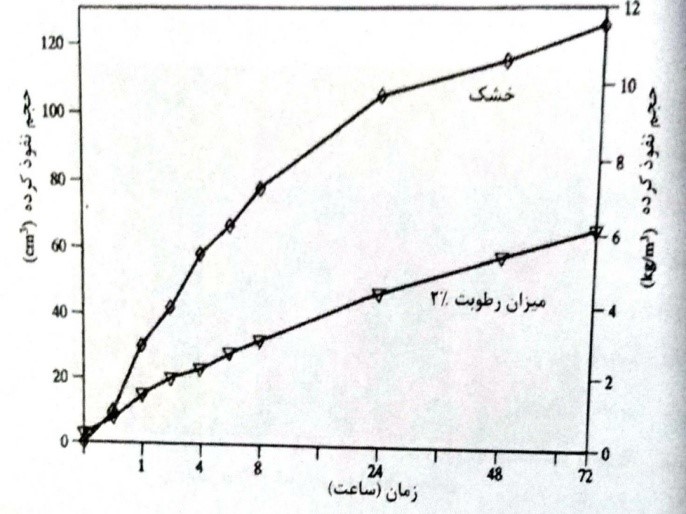
شکل 8-13- جذب بوتانل در بتن با میزان رطوبت های مختلف
شوره زنی در بتن
زمانی که آب از بتنی با تراکم ضعیف، ترک ها یا درزهای اجرایی عبور می کند، آهک موجود در ترکیبات بتن شسته شده و باعث به وجود آمدن رسوب نمکی می شود که به شوره زدگی شناخته می شود. در ابتدا این امر توسط هیدروکسید کلسیم (یکی از محصولات هیدراتاسیون) ایجاد شده و به طور ملایم محلول در آب و از طریق ترک ها و حفره های مویینه بتن به سطح آن منتقل می شود. پس از تخریب آب، هیدروکسید کلسیم جامد با منواکسید کربن موجود در اتمسفر واکنش داده و کربنات کلسیم آهک (CaCO) را به وجود می آورد که رسوبات سفید رنگ روی سطح بتن است.
شوره زنی اولیه را می توان با استفاده از قلمو و آب زدود؛ اما برای حذف رسوبات سنگین ممکن است به اسیدشویی سطح بتن نیاز باشد. اسید مورد استفاده برای این کار هیدروکلرید اسید (HCI) با غلظت 1:10 یا 1:20 در هر دوره مصرف است. زمانی که اسید برای واکنش با آهک استفاده شد، عملکردش متوقف می شود؛ اما سطح بتن به منظور حذف نمک هایی که تشکیل شده باید با آب شسته شود.
شوره زنی و شستگی (Leaching) برای بتن مضر است. چرا که علاوه بر لکه دار کردن و ایجاد ظاهری زشت، موجب تسریع در روند کربناسیون نیز می شود. در بتن مسلح احتمال خوردگی فولاد، به دلیل کربناسیون و نفوذپذیری افزایش می یابد. بنابراین لازم است مواد ساخت بتن، سنگدانه و افزودنی های شیمیایی شده و به صورت صحیح اجرا و متراکم شود.
 شکل 8-14- شوره زنی عامل تخریب بتن
شکل 8-14- شوره زنی عامل تخریب بتن
تهاجم سولفاتی
شاید معمولی ترین و گسترده ترین شکل تهاجم شیمیایی به بتن را سولفات ها داشته باشند. سولفات ها اغلب در آب زیرزمینی به خصوص زمانی که مقادیر زیادی رس در خاک موجود است و در آب دریا که سولفات یون اصلی آن است وجود دارد. آب های زیرزمینی ممکن است در نزدیکی زائدات صنعتی مثل زائدات معادن، توده های انباشته شده سرباره و انباشته نخاله ها تجمعی از سولفات را دارا باشند. سولفات های موجود در آب باران در اثر آلودگی هوا و یا در اثر تولید و رشد مواد بیولوژیکی می توانند خرابی کندی حتی در بتن های بالای سطح زمین داشته باشند.
 شکل 8-15- تخریب بتن به دلیل حمله یون های سولفات
شکل 8-15- تخریب بتن به دلیل حمله یون های سولفات
اکثر خاک ها دارای مقداری سولفات به شکل گچ (به طور شاخص 01/0 تا 05/0 درصد SO4) می باشند. این مقدار برای بتن بی ضرر است. حلالیت گچ در آب در دماهای معمولی نسبتاً محدود است. (1400 mg/liter SO4) غلظت های بیشتر سولفات در آب های زیرزمینی، کلاً به علت وجود منیزیم و سولفات های قلیایی می باشد. سولفات آلومینیم غالباً در خاک و آب های کشاورزی موجود است. پساب کوره هایی که از سوخت هایی با گوگرد زیاد، استفاده می کنند و پساب صنایع شیمیایی، ممکن است دارای اسید سولفوریک باشند. از بین رفتن مواد آلی در مرداب ها، دریاچه های کم عمق، گودال ها استخراج معادن و لوله های فاضلاب اغلب منجر به تشکیل H2S می شود که می تواند بر اثر کنش باکتریایی، به اسید سولفوریک تبدیل گردد.
کاهش کیفیت بتن، در نتیجه واکنش های شیمیایی بین سیمان پرتلند هیدراته شده و یون های سولفات ناشی از یک منبع خارجی، شناخته شده است، که این امر به دو شکل مشخصاً متفاوت از یکدیگر صورت می گیرد. اینکه کدامیک از فرآیندهای آسیب دیدگی در یک مورد مشخص غالب شود بستگی به غلظت و منبع یون های سولفات (یعنی کاتیون مربوط) در آب تحت تماس و ترکیب خمیر سیمان در بتن دارد. حمله سولفات می تواند به شکل انبساط بتن ظاهر شود. وقتی که بتن ترک می خورد نفوذپذیری آن افزایش می یابد و آب مهاجم راحت تر به داخل آب نفوذ می کند و بنابراین آسیب دیدگی بتن تسریع می شود.
مکانیزم تهاجم سولفاتی
فازهایی از سیمان پرتلند هیدراته، که دارای هیدروکسید کلسیم و آلومین می باشند، آسیب پذیری بیشتری در برابر حمله یون های سولفات دارند. در هنگام هیدراتاسیون، در سیمان های پرتلند با بیش از 5 درصد C3A بیشتر آلومین به صورت هیدرات منوسولفات،.H18 C3A.C می باشد. اگر مقدار C3A سیمان بیش از 8 درصد باشد، محصولات هیدراتاسیون نیز شامل C3A.CH.H18 خواهد بود. در خمیرهای سیمان پرتلند، در مجاورت هیدروکسید کلسیم وقتی که خمیر سیمان با یون سولفات تماس پیدا می کند، هر دوی هدرات ها دارای آلومین، به یک شکل پرسولفات (یعنی اترینگایت .H32 C3A.3C) تبدیل می شوند:
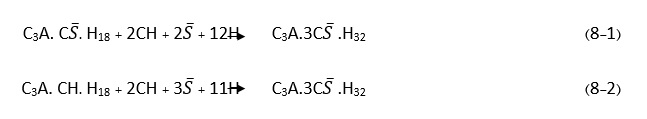
اعتقاد عمومی بر این است که انبساط های مرتبط با سولفات، در بتن مربوط به اترینگایت می باشد. با این وجود، مکانیزم هایی که از طریق آنها، تشکیل اترینگایت باعث انبساط می گردد هنوز موضوعی جدال برانگیز است. اعمال فشار ناشی از بلورهای در حال رشد اترینگایت، متورم شدن ناشی از جذب آب در محیط قلیایی توسط اترینگایت کم متبلور شده، دو نمونه از چندین فرضیه ای هستند که بیشتر پژوهشگران از آن دفاع می کنند.
گچ حاصل از واکنش های تبادل کاتیون نیز قادر به منبسط شدن است، با این وجود، مشاهده شده است که آسیب دیدگی خمیر سیمان پرتلند سخت شده بر اثر تشکیل گچ، شامل فرآیندی می شود که منجر به کاهش سختی و مقاومت می گردد. ادامه این فرآیند، انبساط و ترک خوردگی و تبدیل نهایی مصالح به خمیر نرم و غیر چسبنده می باشد.
بسته به نوع کاتیون موجود در محلول سولفات (یعنی Na+ یا Mg2+) هم هیدروکسید کلسیم و هم C-S-H خمیر سیمان پرتلند ممکن است بر اثر حمله سولفاتی، به گچ تبدیل شوند.
 (8-3) Na2SO4 + Ca(OH)2 + 2H2O CaSO4.2H2O+2NaOH
(8-3) Na2SO4 + Ca(OH)2 + 2H2O CaSO4.2H2O+2NaOH
 (8-4) MgSO4 + Ca(OH)2 + 2H2O CaSO4.2H2O+Mg(OH)2
(8-4) MgSO4 + Ca(OH)2 + 2H2O CaSO4.2H2O+Mg(OH)2
 3MgSO4 + 3CaO.2SiO2.3H2O 3(CaSO4.2H2O)+ 3Mg(OH)2+ 2SiO2.H2O
3MgSO4 + 3CaO.2SiO2.3H2O 3(CaSO4.2H2O)+ 3Mg(OH)2+ 2SiO2.H2O
در مورد اول (یعنی حمله سولفات سدیم) تشکیل هیدروکسید سدیم (به عنوان محصول جنبی واکنش) تداوم قلیایی زیاد را (که برای پایداری فاز سیمانی اصلی، یعنی C-S-H ضروری است) در سیستم تضمین می کند. از طرف دیگر، در مورد دوم یعنی حمله سولفات منیزیم) تبدیل هیدروکسید کلسیم به گچ، با تشکیل هیدروکسید منیزیم نسبتاً نامحلول و با قلیائیت کم همراه است. در نتیجه، پایداری C-S-H در سیستم کاهش یافته و تحت تهاجم سولفات نیز قرار می گیرد. بنابراین حمله سولفات منیزیم به بتن، خیلی شدیدتر می باشد.
 تاثیر آتش بر بتن
تاثیر آتش بر بتن
کنترل حمله سولفات
عوامل موثر در حمله سولفاتی عبارتند از:
- مقدار و ماهیت سولفات موجود
- سطح سفره آب زیرزمینی و تغییرات فصلی آن
- جریان آب زیرزمینی و تخلخل خاک
- شکل ساختمان
- کیفیت بتن
میزان حمله به یک سازه بتنی ای که از اطراف در معرض آب سولفاتی قرار دارد کمتر از وقتی است که رطوبت، بر اثر تبخیر از یک یا چند سطح آن از بین می رود. بنابراین، زیرزمین ها، آبروها، دیوارهای حائل و دال های واقع بر روی زمین آسیب پذیری بیشتری در مقایسه با پی و شمع ها دارند.
کیفیت بتن، به ویزه نفوذپذیری کم آن، بهترین محافظت در مقابل حمله سولفاتی می باشد. ضخامت کافی بتن، مقدار زیاد سیمان، نسبت آب به سیمان کم و تراکم و عمل آوری صحیح بتن تازه، از عوامل مهمی هستند که به نفوذپذیری بتن کمک می کنند. در صورت ترک خوردن بتن، بر اثر جمع شدگی ناشی از خشک شدن، مل یخ زدگی و خوردگی میلگرد یا علل دیگر، با استفاده از سیمان های ضد سولفات، می توان ایمنی بیشتری را در مقابله با این موارد ایجاد نمود.
سیمان پرتلند دارای کمتر از 5 درصد C3A (سیمان نوع V) تحت شرایط ملایم حمله سولفاتی (یعنی هنگامی که فقط واکنش های تشکیل دهنده اترینگایت مورد توجه هستند) به قدر کافی در برابر حمله ی سولفات مقاوم می باشد. با ین وجود، هنگامی که غلظت های زیاد سولفات در حد 1500 میلی گرم بر لیتر بیشتر در میان باشد، تیپ V سیمان پرتلند ممکن است در برابر واکنش های تبادل کاتیون متضمن تشکیل گچ موثر نباشند مخصوصاً اگر مقدار C3A سیمان زیاد باشد. تجربه نشان می دهد که تحت چنین شرایطی، سیمان هایی که دارای هیدروکسید کلسیم بوده و یا اصلاً دارای هیدروکسید کلسیم نمی باشند، در هیدراتاسیون خیلی بهتر عمل می نمایند. از جمله این سیمان ها، سیمان های پرآلومین، سیمان های پرتلند روباره ی آهن گدازی با بیشتر از 70 درصد روباره، سیمان های پرتلند پوزولانی با حداقل 25 درصد پوزولان (وزولان طبیعی، خاک رس کلسینه، یا خاکستر بادی با کلسیم کم). شکل 8-16
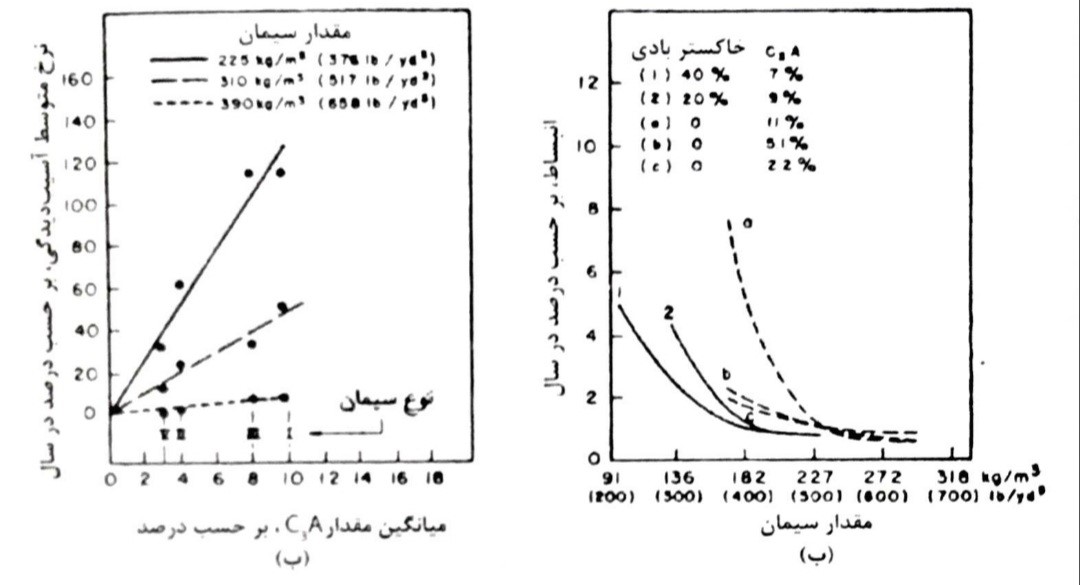 شکل 8-16- تاثیر نوع و مقدار سیمان و افزودن خاکستر بادی بر روی حمله سولفاتی در بتن
شکل 8-16- تاثیر نوع و مقدار سیمان و افزودن خاکستر بادی بر روی حمله سولفاتی در بتن
درحالی که کاربرد سیمان ضد سولفات برای کنترل تهاجم سولفاتی حیاتی است؛ اما این سیمان نمی تواند مقاومت سولفاتی بتن با نفوذپذیری زیاد را تضمین نماید. برای نفوذپذیری کم در بتن نیاز به نسبت آب به سیمان کم، تراکم کافی، عمل آوری کافی و طراحی برای حداقل ترک خوردگی می باشد.
واکنش شیمیایی در سنگدانه ها
وجود حتی مقادیر اندک اجزاء مضر و ناخالصی در سنگدانه ها، می تواند اثر نامطلوب عمده ای بر عملکرد بتن داشته باشد و از این رو، شناسایی نوع و مدار این مواد نامطلوب، از اهمیت ویژه ای برخوردار می باشد. در جدول (8-4) طیف وسیعی از انواع اجزاء مضر مورد توجه و اثرات احتمالی آنها بر روی بتن ارائه شده است. برخی رس ها می توانند اثر نامطلوبی برکارایی داشته و می توانند با برخی فوق روان کننده های پلی کربوکسیلیت، بر هم کنش داشته باشند و منجر به افت کارایی آنها در عمل کاهش آب گردند (شکل 8-17). وجود میکا که مقدار آن را می توان به وسیله سنگ نگاری از طریق شمارش نقاط تعیین نمود، مهم می باشد؛ زیرا میکا (بیش از 10 درصد نسبت به اندازه) ممکن است منجر به افزایش مصرف آب جداشدگی و آب انداختگی گردد.
| جدول 8-4- اجزاء مضر در سنگدانه ها |
|---|
| اجزاء مضر | اثرات احتمالی بر بتن |
| ناخالصی های آلی | برگیرش و سخت شدن اثر می گذارد،
ممکن است موجب آسیب گردد. |
مصالح ریزتر از الک شماره 200
(یعنی ریزدانه های در ابعاد میکرون) | بر پیوستگی اثر می گذارد، نیاز آب را
افزایش می دهد. |
| زغال سنگ، لیگنیت یا دیگر مصالح سبک | بر دوام اثر می گذارد، ممکن است موجب ایجاد لکه ها و بیرون پریدگی ها گردد. |
ذرات نرم، کلوخه های رسی و
ذرات ترد (شکننده) | بر کارایی و دوام اثر می گذارد، ممکن است موجب ایجاد بیرون پریدگی ها گردد. |
| سنگدانه واکنش پذیر با قلیا | انبساط غیرعادی، ترک خوردگی الگویی،
بیرون پریدگی ها |
اغلب اجزاء بالقوه مضر توصیف شده در جدول (8-4) دارای اثر غیر مستقیمی بر دوام بتن می باشند. یعنی اغلب آنها خواص سنین اولیه مانند زمان گیرش، کارای و مصرف آب را تحت تاثیر قرار می دهند که در برخی موارد اثر نامطلوبی بر کیفیت بتن سخت شده می باشد. اگر آب در محل مثلاً برای جبران تقاضای آب بیشتر اضافه گردد، آب اضافی منجر به کاهش مقاومت، افزایش نفوذپذیری و کاهش دوام بلند مدت می گردد. به طور مشابه، اگجر این اثرات نامطلوب منجر به ترک خوردگی بتن گردند، عملکرد بلند مدت بتن کاهش می یابد.
انواع دیگر ناخاصی ها و مواد نامطلوب در سنگدانه ها ممکن است دارای اثر مستقیمی بر عملکرد بتن باشند. مانند چرت ها، سنگدانه های حساس به واکنش های قلیا – سیلیس (ASR) و قلیا – کربنات (ACR)، توده های رسی، محصولات شکننده و خرد شونده و زغال، همگی می توانند منجر به تخریب بتن گردند.
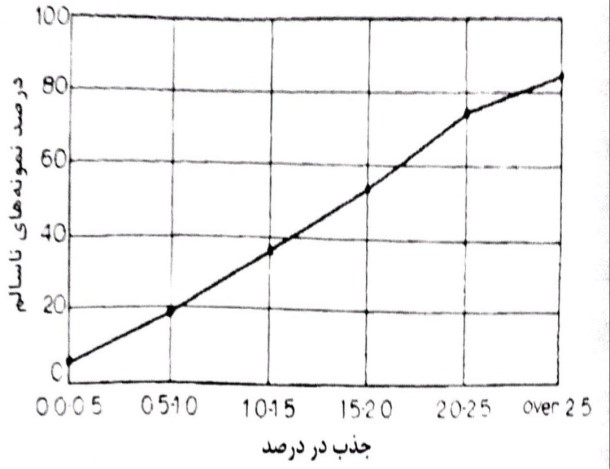
شکل 8-17- توزیع نمونه های سنگدانه های سالم و ناسالم به صورت تابعی از جذب آب
واکنش قلیا – سیلیسی (ASR)
بسته به درجه بی نظمی ساختمان سنگدانه، تخلخل و اندازه ذرات آن، ژل های قلیایی – سیلیکاتی با ترکیب شیمیایی متغیر در حضور هیدروکسید و یون های فلز قلیایی تشکیل می شوند. نوع حمله بتن می تواند شامل پلیمریزاسیون زدایی یا شکستن ساختمان سیلیسی سنگدانه توسط یون های هیدروکسیل و به دنبال آن جذب یون های فلز قلیایی واقع بر روی سطح محصولات تازه به وجود آمده حاصل از واکنش، باشد. در اینجا نیز، مثل خاک های دریایی دارای سدیم یا پتاسیم، که در سطح آنها جذب شده اند وقتی که ژل های سیلیکات قلیایی در تماس با آب قرار می گیرند، بر اثر جذب کردن مقدار زیادی آب از طریق اسمزی، متورم می شوند. فشار هیدرولیکی ای که به این صورت توسعه می یابد ممکن است منجر به انبساط و ترک خوردگی ذرات سنگدانه ای که تحت تاثیر قرار می گیرند، ماتریس خمیر سیمان احاطه کننده ی سنگدانه ها و بتن شود.
حلالیت ژل های سیلیکاتی قلیایی در آب، دلیل تحرک آنها از داخل سنگدانه به نواحی ریز ترک های موجود در داخل سنگدانه و هم داخل بتن، می باشد. در دسترس بودن پیوسته آب در داخل بتن، باعث بزرگ شدن و توسعه یافتن این ریز ترک ها می شود تا آنکه نهایتاً به سطح بیرونی بتن برسند. شکل ترک، نامنظم و بی قاعده است و در نتیجه با آن ترک نقشه ای گفته می شود.
هرچند باید متذکر شد که شواهد بر واکنش قلیایی سنگدانه ها در بتن ترک خورده، لزوماً ثابت نمی کند که علت اصلی ترک خوردگی، این واکنش می باشد. در بین عوامل دیگر، توسعه تنش های داخلی بستگی به مقدار، اندازه و نوع سنگدانه واکنش زای موجود و ترکیب شیمیایی ژل سیلیکات قلیایی تشکیل شده، دارد. وقتی مقدار زیادی از مصالح واکنش زا به صورت ذرات ریز جدا از هم (یعنی کمتر از mµ 75) باشند، ممکن است شواهد قابل توجهی از واکنش وجود داشته باشد ولی انبساطی به اندازه قابل توجه، رخ ندهد. از طرف دیگر خیلی از سوابق مورد مطالعه در مورد انبساط و ترک خوردگی بتن، که به واکنش قلیایی سنگدانه ها نسبت داده می شوند، همراه با وجود ذرات واکنش زای قلیایی، به اندازه ماسه در سنگدانه، خصوصاً در اندازه بین 1 تا 5 میلیمتر هستند. توضیحات قانع کننده ای برای این مشاهدات به علت فعل و انفعال همزمان چندین عامل پیچیده در دسترس نمی باشد. به هر حال تمایل به جذب آب کمتر از ژل های قلیایی – سیلیسی با نسبت سیلیس به قلیایی بیشتر و آزاد شدن فشار هیدرولیکی در سطح ذره واکنش زا وقتی که اندازه آن خیلی کوچک است، ممکن است به طور جزئی این مشاهدات را توجیه نماید.
 ساختمانی بتنی در آتش
ساختمانی بتنی در آتش
عوامل تاثیرگذار انبساط
«استنتون» توانست عوامل کنترل کننده انبساط قلیایی – سنگدانه را به شرح زیر تعریف کند:
- سیلیس فعال طبیعی
- مقدار سیلیس واکنش کننده
- اندازه ذرات مصالح واکنش کننده
- مقدار قلیایی موجود
- مقدار رطوبت موجود
در واکنش قلیایی – سیلیس مقدار سیلیس اهمیت دارد با توجه شکل 8-18 مشخص می شود که انبساط حداکثر در یک مقدار معین سیلیس فعال رخ می دهد و در درصدهای بیشتر، انبساط کاهش می یابد. نامناسب ترین درصد تابع شکل سیلیس فعال، درجه قلیاییت و نسبت W/C است.
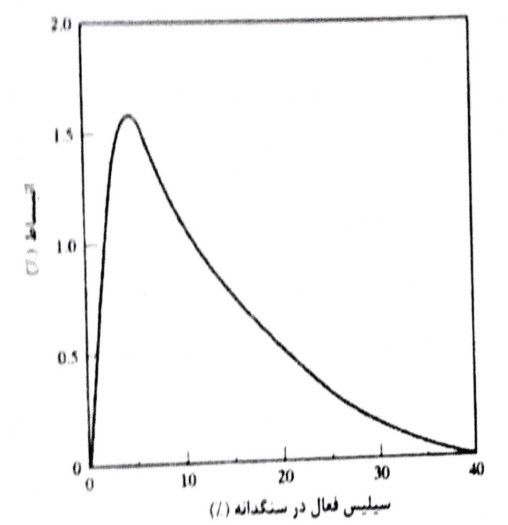 شکل 8-18- اثر مقدار سیلیس فعال در سنگدانه بر انبساط بتن ناشی از واکنش قلیایی – سنگدانه
شکل 8-18- اثر مقدار سیلیس فعال در سنگدانه بر انبساط بتن ناشی از واکنش قلیایی – سنگدانه
نامناسب ترین درصد ممکن است در محدوده دو تا ده درصد باشد؛ اما می تواند به مقدار زیاد تا صد در صد هم برسد. همچنین نوع ذرات مصالح واکنش کننده (جدول 8-5) و اندازه عامل مهمی در واکنش نیز محسوب می گردند. (شکل 8-19)
| جدول 8-5- شکل سیلیس فعال در سنگ ها که در واکنش قلیایی – سیلیسی سهیم هستند |
|---|
| جزء فعال | شکل فیزیکی | در انواع سنگ ها که در آن پیدا می شود | رخداد |
| اوپال | غیر متبلور
(بی شکل) | سیلیس دار (اوپالی، سنگ های آهک، چرت ها، شیت رسوبی فلینت ها) | گسترده |
| شیشه سیلیس | غیر متبلور | شیشه های آتشفشانی (رئولیت)، اندیبت (داسیت) و توف ها، شیشه های مصنوعی | مناطبق با مبدا آتشفشانی، سنگریزه های رودخانه ای با مبدا مناطق آتشفشانی،
محتوی شیشه |
| کلسدونی | کوارتز ضعیف
بلوری شده | سنگ آهک های سیلیس دار و ماسه سنگ ها، چرت ها و فلینت ها | گسترده |
کریستوبالیت
تریدیمیت | بلوری | سنگ های اوپالی، سرامیک سوخته | غیر معمول |
| کوارتز | بلوری | کوارتزدار، ماسه ها، بسیاری از سنگ های آذرین و دگرگونی (مانند گرانی ها و شیست ها) | معمول؛ اما فقط وقتی فعال است که تحت کرنش شدید قرار گیرد و یا ریزبلوری باشد. |
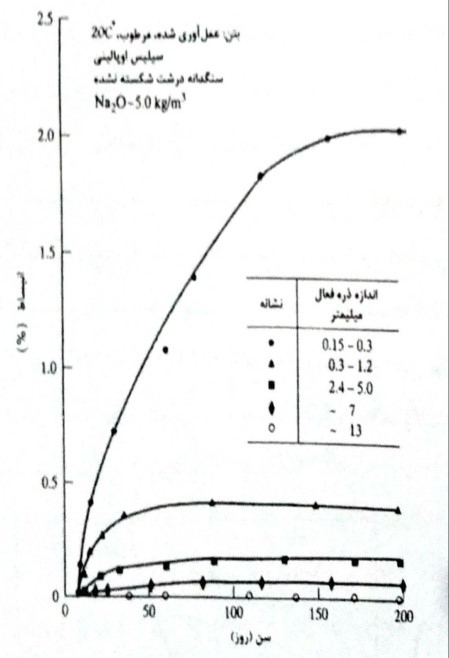 شکل 8-19- اثر اندازه ذره فعال بر ارتباط بین انبساط و بتن
شکل 8-19- اثر اندازه ذره فعال بر ارتباط بین انبساط و بتن
هنگامی که سیمان تنها منبع یون های قلیایی بتن باشد و ضمناً به وجود اجزای تشکیل دهنده قلیایی واکنش زا در سنگدانه مکوک باشیم، تجربه نشان می دهد که استفاده از سیمان پرتلند با قلیایی کم (کمتر از 06/0 درصد معادل Na2O) بهترین روش محافظت در برابر حمله قلیایی می باشد. (شکل 8-20)
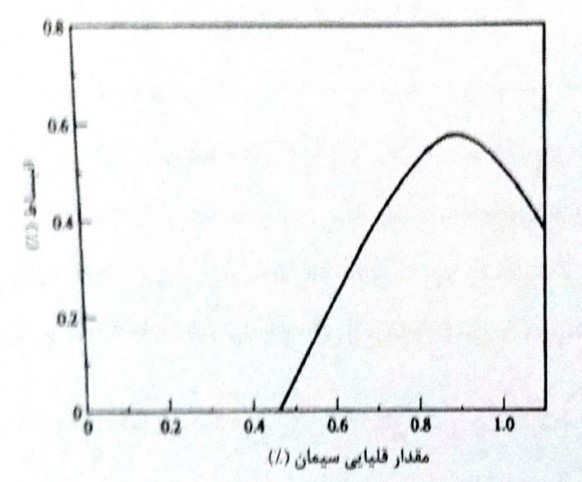 شکل 8-20- اثر مقدار قلیایی سیمان بر انبساط قلیایی – سنگدانه
شکل 8-20- اثر مقدار قلیایی سیمان بر انبساط قلیایی – سنگدانه
اگر قرار است که از ماسه ساحلی با ماسه و شن لایروبی شده از دریا استفاده شود، سنگدانه ها باید با آب شیرین شسته شوند تا این اطمینان حاصل شود که مقدار کل قلیایی های ناشی از سیمان و سنگدانه ها، از 3 کیلوگرم بر متر مکعب بتن تجاوز نمی کند. در صورتی که سیمان پرتلند با قلیایی کم، در دسترس نباشد. برای کاهش مقدار قلیایی های بتن می توان از سیمان با قلیایی زیاد را با مواد افزودنی یا پوزولانی، نظیر روباره آهن گدازی دانه ای شده، شیشه آتشفشانی (پامیس آسیاب شده)، رس کلسینه، خاکستر بادی یا دوده سیلیس متراکم جایگزین کرد (شکل 8-12). استفاده از مواد افزودنی پوزولانی و همچنین هوازی ها علاوه بر کاهش مقدار موثر قلیایی ها، موجب تشکیل محصولات قلیایی – سیلیکاتی با انبساط کم و نسبت سیلیس به قلیایی بالا می شود.
 شکل 8-21- اثر پوزولان بر پیشرفت واکنش قلیایی – سنگدانه
شکل 8-21- اثر پوزولان بر پیشرفت واکنش قلیایی – سنگدانه
واکنش قلیا – کربناتی (ACR)
واکنش قلیایی – کربناتی میان هیدروکسیدهای قلیایی و برخی سنگ آهک های دولومیتی شبه رسی اتفاق می افتد. این دولومیت ها با خمیری از مواد معدنی رسی و کلسیتی ریزدانه با لوزی های وجه های دولیمیتی پراکنده، قابل شناسایی می باشند. این واکنش از طریق انبساط سریع و ترک خوردگی گسترده بتن آشکار می شود و ساختارهای تحت تاثیر ACR معمولاً ترک خوردگی را در مدت 5 سال یا کمتر نشان می دهند. هر چند درباره مکانیزم های دقیق موجود در این فرآیند، اتفاق نظر وجود ندارد؛ اما این موضوع به طور عام پذیرفته شده است که این واکنش، با فرآیند دولومیت زدایی به صورت زیر است:
(8-5) CaMg(CO3)2 +2ROH CaCO3 +Mg(OH)2 +R2CO3
در این معادله R نشان دهنده K یا Na می باشد؛ اما از آنجا که این واکنش منجر به کاهش حجم جامد می گردد، انبساط باید ناشی از یک مکانیزم دیگر باشد. چندین تئوری دیگری برای مکانیزم انبساط، ارائه شده است که عبارتند از:
- فشارهای هیدرولیکی ناشی از مهاجرت مولکول های آب و یون های قلیایی به سمت فضای محدود خمیر رس – کلسیت در اطراف لوزی های دولومیت.
- جذب یون های قلیایی و مولکول های آب بر روی سطح کانی های رسی «فعال» پراکنده شده در اطراف ذرات دولومیت.
- رشد و آرایش مجدد محصولات حاصل از دولومیت زدایی (یعنی بروسیت و کلسیت).
کربنات قلیایی تولید شده در واکنش دولومیت زدایی ممکن است با آهک موجود در خمیر سیمان به صورت زیر واکنش دهد:
 (8-6) R2CO3+ Ca(OH)2 CaCO3+2ROH
(8-6) R2CO3+ Ca(OH)2 CaCO3+2ROH
به این ترتیب، تولید مجدد مواد قلیایی برای واکنش بیشتر صورت می گیرد. بنابراین، با فراهم شدن مواد قلیایی کافی جهت آغاز واکنش، این فرآیند ممکن است به طور مستقل از مقدار مواد قلیایی موجود در بتن ادامه یابد. این پدیده می تواند توضیح دهد که چرا سیمان های با خاصیت قلیایی پایین، در کنترل واکنش صدمه زننده در برخی موارد، موثر نمی باشند.
تهاجم اسیدها و بازها
خمیر سیمان هیدراته شده یک ماده قلیایی است و بنابراین تهاجم مواد قلیایی دیگر به آن اغلب انتظار نمی رود. خاصیت قلیایی با غلظت بالای مواد در تماس با بتن در فرآیندهای صنعتی می تواند موجب خرابی شود که فرآیند آن به غیر از واکنش شیمیایی مستقیم با یون های هیدروکسید می باشد. شرایط برای محلول های اسیدی کاملاً متفاوت است که اساساً این مواد سبب حمله به مواد قلیایی بتن می شوند. به طور کلی آب زیرزمینی اسیدی متداول نیست و تشکیل اسید محدود به نواحی لجنی و مردابی می شود که در آن تجزیه مواد آلی به طور وسیع صورت می گیرد. آب های اسیدی همچنین می تواند در محل های دفن زباله ها یا نزدیک آنها و در جاهایی که عملیات معدنی و انبار کردن مواد زائد معدنی در جریان است، تشکیل شود. شرغیط اسیدی حاد ممکن است در زائدات صنعتی و کشاورزی و به ویژه در صنایع فرایند مواد غذایی و حیوانی وجود داشته باشد. یون هیدروژن آب شستگی هیدروکسید کلسیم را تسریع می نماید:
 (8-7) Ca(OH)2 +2H+ Ca2++2H2O
(8-7) Ca(OH)2 +2H+ Ca2++2H2O
در غلظت بالای یون هیدروژن C-S-H مورد حمله واقع شده و ژل سیلیس شکل می گیرد.
 (8-8) 3CaO.2SiO2.3H2O+6H+ 3Ca2++2(SiO2.nH2O)+6H2O
(8-8) 3CaO.2SiO2.3H2O+6H+ 3Ca2++2(SiO2.nH2O)+6H2O
طبیعت آنیون همراه با یون هیدروژن ممکن است، شرایط را تشدید کند. اسید سولفوریک و اسید کربنیک اجزای معمولی در آب زیرزمینی هستند. یون سولفات در حمله سولفاتی شرکت می کند و در نتیجه اسید سولفوریک اساساً خورنده است. اسید کربنیک هم می تواند بسیار خورنده باشد؛ زیرا می تواند سبب تشکیل بی کربنات کلسیم محلول شود.
 (8-9) Ca(OH)2+H2CO3 Ca(HCO3)2 +H2O
(8-9) Ca(OH)2+H2CO3 Ca(HCO3)2 +H2O
هر اسیدی که بتواند نمک های محلول کلسیم ایجاد کند، می تواند مخرب باشد. درحالی که اسید تشکیل دهنده نمک کلسیم نامحلول سبب ایجاد رسوب شده و بتن را از خرابی بیشتر محافظت می کند. مثال هایی در جدول 8-6 آورده شده است.
| جدول 8-6- تهاجم اسیدی به بتن |
|---|
| اسید | فرمول | احتمال پیدایش در |
| اسید هیدروکلریک | HCI | صنعت شیمیایی |
| اسید نیتریک | HNO3 | تولید کود |
| اسید استیک | CH3CO2H | فرآیند تخمیر |
| اسید فرمیک | H.CO2H | فرآیند مواد غذایی و رنگرزی |
| اسید لاکتیک | C2H4(OH).CO2H | صنعت لبنیات |
| اسید تانیک | C76H52O46 اسیدهایی که نمک غیرمحلول تولید می کنند. | صنعت دباغی، آب زغال |
| اسید فسفریک | H3PO4 | تولید کود |
| اسید تارتاریک | [CH(OH).CO2H]2 | تولید مشروبات |