استفاده از آهن در بتن بخش مهمی از زیرساخت های ما بر پایه بتن مسلح است، چرا که بتن بار فشاری را گرفته و فولاد داخل آن، بار کششی را تحمل مینماید. دوام این ماده مرکب براساس پایداری شیمیایی بسیار خوب سیمان پرتلند هیدراته شده و ایجاد لایه محافظ (مقاوم) بر روی فولاد در محلول حفره ای قلیایی بتن (pH 5/12 تا 5/13) است. در مقایسه با آگاهی از این حقیقت قطعی در ارتباط با دمام سازه های بتن مسلح به فولاد، دانش اندکی درباره شیمی سطح آهن و آلیاژهای آهن در محیط های قلیایی شبیه سازی شده، در محلول های حفره ای مصنوعی حاوی کاتیون های سدیم، کلسیم و پتاسیم و همچنین سولفات ها، و یا در بتن وجود دارد. اخیرا توسط جویرت و همکاران تجزیه و حفاظت آهن با روش های الکتروشیمیایی و طیف سنجی رامان برجا، مورد مطالعه قرار گرفته است، که نشان می دهد با افزایش پتانسیل، یک فرآیند اکسیده شدن تدریجی برای لایه اکسید، مشاهده می گردد. در مقادیر پتانسیل بسیار پایین، اکسید مغناطیسی آهن (Fe3O4) وجود دارد و در پتانسیل های آندی بالاتر، a-FeOOH و Fe2O3 تشکیل می شوند. این نتایج با آزمایشات کوتاه مدت بر روی آهن کف دار قرار گرفته در محلول های قلیایی، مطابقت دارد. در ادامه این مقاله ازکلینیک بتن ایران در مورد روش های آزمایش و نتایج آن که در مقاوم سازی ساختمان بسیار تاثیرگذار است، بیشتر توضیح خواهیم داد.
روش های آزمایشگاهی
از نقطه نظر ترمودینامیکی، اُکسی هیدروکسیدها و اکسیدهای آهن در pH بالا، ترکیبات پایداری هستند که این امر منجر به تشکیل یک لایه نازک اکسید محافظ (لایه محافظ) برسطح آهن در محیط های قلیایی و بتن می گردد. این حالت مقاوم در مسلح سازی (میلگرد) می تواند از طریق کربناسیون (واکنش محلول حفره ای قلیایی با CO2 هوا) و افت pH ناشی از آن و یا از طریق ورود یون های کلرید، از بین رفته و منجر به حمله خوردگی موضعی می گردد. از منابع علمی و تجربیات عملی موجود می توان دریافت که قرارگیری بلندمدت فولاد در معرض محیط های قلیایی (سالخوردگی لایه محافظ)، مقدار بحرانی کلرید برای آغاز خوردگی موضعی ناشی از کلرید را افزایش می دهد، همانگونه که این موضوع برای محلول حفره ای، ملات و بتن گزارش شده است. سالخوردگی لایه محافظ به طور همزمان، تاثیر کاهش کاتدی اکسیژن را تقلیل داده و در نتیجه ممکن است نرخ خوردگی را کاهش دهد. در نتیجه، ضخامت، ترکیب و پیکره بندی الکترونیکی این لایه های نازک اکسید آهن (لایه های محافظ) در محیط های قلیایی، برای رفتار خوردگی فولاد در بتنف اهمیت بسزایی دارند.
در این کار، نتایج مطالعه ترکیبی تحلیل الکتروشیمیایی و XPS سطح فولاد و آلیاژهای Fe10Cr در محیط های قلیایی، گزارش شده است. نتایج به دست آمده از نظر نسبت Fe(II)/Fe(III) آهن در لایه و رابطه آن با پتانسیل اتصال کوتاه و اثر افزودن کرم برپایداری لایه محافظ، مورد بحث قرار می گیرند.
مصالح و آماده سازی نمونه ها
صفحات آهن (99/99%) توسط GoodFellow و آلیاژهای Fe10Cr توسط انجمن شیمی فیزیک و الکتروشیمی دانشگاه داسلدورف تهیه شدند. نمونه ها که قبلا در نگهدارنده نمونه XPS قرار گرفته بودند، در آب مقطر با استفاده از کاغذ سمباده سیلیکون کاربید 200، 320، 500 و 1000 و در اتانول با پرداخت µm1 با خمیر الماس، سایش یافتند (این حالت جلادهی مکانیکی نامیده می شود). نمونه ها با اتانول شسته شده، تحت بخار نیتروژن خشک شده و تحت نیتروژن به داخل طیف سنج انتقال یافتند.
نمونه ها توسط XPS بلافاصله پس از فرو بردن در محلول های قلیایی هوازدایی شده با pH 13 و پس از قرارگیری در معرض هوا به مدت طولانی (تا 20 روز) در رطوبت نسبی 35% و سپس فرو بردن در محلول قلیایی به مدت 24 ساعت، توسط XPS مورد تحلیل قرار گرفتند.
عوامل شیمیایی و محلول ها
عامل شیمیایی اتانول و آب مقطر (λ=1.4µs cm-1 در دمای °C20؛ 5/6 pH ≈) برای جلادهی مکانیکی مورد استفاده قرار گرفتند. محلول های قلیایی با pH 13 از NaOH با درجه بندی تحلیلی (Carlo Ebra) تهیه شدند. pH محلول با استفاده از یک pH س��ج 654 Metrohm کنترل می شد. محلول های هوازدایی شده از طریق ایجاد حباب های گار آرگون برای مدت حداقل 4 ساعت، آماده سازی شدند.
آزمایشات الکتروشیمیایی
آزمایشات الکتروشیمیایی در یک محفظه (سلول) الکتروشیمیایی استوانه ای انجام شدند که قطر دهانه آنها در یک سمت برابر cm1 (مساحت سطح cm 278/0) است تا سطح نمونه در معرض محلول قرار گیرد. محلول های اشباع شده با اکسیژن و هوازدایی شده با گار آرگون، مورد استفاده قرار گرفتند. ثبت مقادیر پتانسیل اتصال کوتاه توسط یک پتانسیواستات 237PAR تحت کنترل رایانه، صورت گرفت. یک الکترود کالومل اشباع (SCE) با یک دیافراگم حفاظت دوگانه برای کلیه آزمایشات مورد استفاده قرار گرفت.
برای خرید انواع پوشش های محافظتی بتن با بهترین قیمت اینجا کلیک کنید.
طیف سنجی نوری الکترونی اشعه ایکس
تحلیل های XPS در یک طیف سنج 200ESCALAB (شرکت وکیوم ژنراتور، انگلستان)، انجام گرفت. سیستم خلا، یک پمپ توربوکلولار را شامل می شد کهبا یک تله نیتروژن مایع و یک پمپ تصعید تیتانیوم تنظیم شده بود. فشار باقیمانده در طیف سنج در طول مدت دریافت داده ها همواره پایین تر از Pa7-10×5 بود. منبع اشعه X، (eV6/1486) AlKa بود که با mA 20 و kV 15 کار می کرد. طیف های مورد نظر به صورت دیجیتال به دست آمدند (نرم افزار VGEclipse بر روی 486IBM). تحلیل گر الکترون در حالت انتقال تحلیل گر ثابت (FAT) با یک انرژی عبوری eV 20 با عرض کامل در نیمه ارتفاع حداکثر Ve (FWHM) 1/1= d5/23Ag عمل می کرد. مساحت تحلیل شده تقریبا برابر cm 25/0 بود. دستگاه با استفاده از مواد مرجع تمیز شده با پاشش یون- گاز خنثی SCAA90 از Ag, Cu و Au، واسنجی گردید. برای اهداف واسنجی، خط f7/24Au در eV98/83، خط p3/22Cu در eV67/932، سیگنال CuLMM در eV94/334 و d5/23Ag در eV26/368 مورد استفاده قرار گرفت. اجزاء طیف ها پس از حذف پس زمینه، با توجه به شیرلی و شروود مشخص گردید. نسبت گوسین/لورنتزین و FWHM براساس استانداردها تعیین شده و ثابت نگه داشته شدند و ارتفاع و انرژی حداکثر با استفاده از یک الگوریتم حداقل مربعات تنظیم شدند.
تحلیل کمی
از انتگرال گیری شدت های حداکثر (پیک)، ضخامت و ترکیب لایه سطحی با یک مدل سه لایه تعیین گردید که این کار با در نظر گرفتن باریک شدگی فوتوالکترون ها توسط لایه آلودگی هیدروکربن و لایه محافظ، صورت پذیرفت.
نتایج
اندازه گیری های پتانسیل اتصال باز (OPC) بر روی آهن و نمونه های Fe10Cr در محلول های قلیایی با pH 13 بلافاصله پس از جلادهی مکانیکی و پس از جلادهی مکانیکی و اکسیداسیون هوا، برای دوره های زمانی مختلف در یک دسیکاتور صورت گرفته است. در شکل زیر نمونه هایی از منحنی های OPC در برابر زمان، برای نمونه های Fe و Fe10Cr جلادهی شده مکانیکی که در محلول NaOH با pH 13 غرقاب شده اند، برای محلول های اشباع شده با O2 و هوازدایی شده با Ar نشان داده شده است. OPC نمونه های آهن جلادهی شده مکانیکی بلافاصله پس از غرقاب شدن، بسیار منفی بوده، V 6/0 (SCE)، و پس از غرقاب شدن به مدت 12 ساعت، به سرعت تا رسیدن به مقادیر مثبت تر 357/0- (SCE، هوازدایی شده) V 15/0 (O2, SCE) افزایش می یابد. نمونه های Fe10Cr رفتار مشابهی را نشان می دهند، اما پتانسیل اتصال باز نمونه های جلادهی شده مکانیکی پس از 12 تا 14 ساعت، منفی تر از مقادیر متناظر آهن در هر دو محلول های هوازدایی و هوادهی شده است.
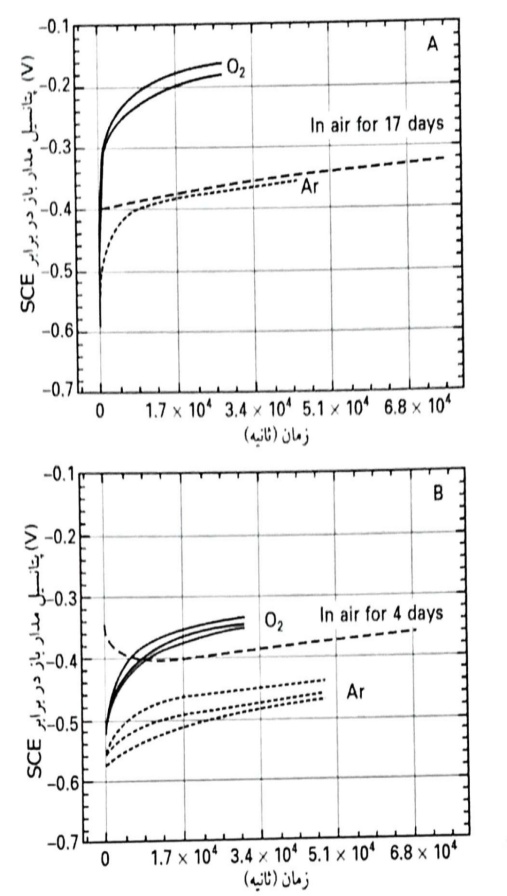
پتانسیل اتصال باز در برابر زمان برای (a) نمونه های آهن جلادهی شده مکانیکی (-) و قرار گرفته در معرض هوا (---) و (b) نمونه های Cr10Fe که در محلول های NaOH غرقاب شده اند.
سری دوم آزمایشات با استفاده از نمونه های آهن و Cr10Fe جلادهی شده مکانیکی و پس نگهداری شده در دسیکاتور برای زمان های بین 1 تا 20 روز در دمای °C 5/0 ±°C25 و رطوبت نسبی 35% صورت گرفت. سپس این نمونه های قرار گرفته در معرض هوا، در محلول قلیایی با pH 13 و هوازدایی شده با گاز آرگون غرقاب شده و OCP برای مدت 20 ساعت اندازه گیری گردید که نتایج نشان داده شده است. پتانسیل اتصال باز برای هر دو نمونه های آهن خالص و Fe10Cr که بلافاصله پس از غرقاب شدن در محلول، در معرض هوا قرار گرفته بودند، بسیار مثبت تر از مقادیر متناظر برای نمونه های با جلادهی مکانیکی است. نمونه های آهن قرار گرفته در معرض هوای خشک، با یک OCP در V(SCE) 4/0- آغاز می شوند و با گذشت زمان بیشتری از غرقاب شدن، پتانسیل ها شبیه مقادیر مربوط به نمونه های با جلادهی مکانیکی می شوند. نمونه های Fe10Cr قرار گرفته در معرض هوا، با یک پتانسیل اتصال باز حدود V(SCE) 3/0- آغاز می کنند؛ در ساعت های اول پس از قرارگیری در معرض محلول، OCP کاهش می یابد، اما در کل مدت آزمایش، مثبت تر از مقادیر مربوط به نمونه های با جلادهی مکانیکی در محلول هوازدایی شده، باقی می ماند . رفتار مشابهی برای شرایط قرارگیری در معرض هوا در زمان های بین 1 تا 20 روز، مشاهده گردید.
نتایج طیف سنجی نوری
طیف سنجی نوری الکترونی اشعه ایکس بر روی نمونه های آهن و Fe10Cr، برای هر دو حالت جلادهی شده مکانیکی و غرقاب شده در محلول NaOH و جلادهی شده مکانیکی، اکسید شده در هوا در یک محیط کنترل شده و غرقاب شده در محلول NaOH با pH 13، صورت گرفت که نتایج آن در ادامه آورده شده است:
سطح با جلادهی مکانیکی
حالت سطح، پس از جلادهی مکانیکی در اتانول، به عنوان یک مرجع تکرارپذیر و حالت آغازین دو آلیاژ مورد مطالعه، انتخاب گردید. همانگونه که از طیف های Fe2p آهن خالص پس از جلادهی مکانیکی مشخص می گردد . سیگنال فلز آهن در هر دو ناحیه p3/22Fe و p1/22Fe از طیف، به وضوح قابل تشخیص است. بیشترین پیک آهن اکسید شده در eV2/10V یافت می شود که نشان دهنده بخش عمده ای در این سیگنال Fe(II) در لایه محافظ سطحی است. نتایج مشابهی برای آلیاژ Fe10Cr نیز به دست آمد .
یک تحلیل دقیق تر از سیگنال آهن p3/22Fe و s1O پس از حذف پس زمینه و برازش منحنی، نشان داده شده است (نمونه ای از آلیاژ Fe10Cr). عرض های کامل در نیمه ارتفاع حداکثر (FWHM) و موقعیت تک تک پیک ها در ناحیه p3/22Fe که برای برازش منحنی استفاده گردید، ثابت نگه داشته شدند و تنها اجازه داده شد که ارتفاع پیک تغییر نماید. همانگونه که قابل مشاهده می باشد، سیگنال آهن2Fe به بخش های مختلفی قابل تجزیه است: بخش مربوط به آهن فلزی (eV7/706)، یک جزء Fe(II) (eV8/708)، اکسید Fe(III) (eV3/710) و اکسی هیدروکسیید Fe(III) (eV1/712). باید توجه نمود که جزء Fe(II) دارای یک سیگنال پیرو در eV5/714 (10% پیک اصلی) می باشد که در این کار، برازش داده شده است. طیف های اکسیژن Ols با سه پیک گوسین/لوزنترین یافت شده در eV50/0 ± 530 (اکسید)، eV1/0±6/531 (هیدروکسید) و eV1/0±9/532 (آب جذب شده سطحی)، برازش داده شده است. نمونه های آهن با جلادهی مکانیکی نتایج مشابهی را نشان دادند که در آنها، بخش اکسی هیدروکسید Fe(III) نسبت به مقادیر متناظر در آلیاژ Fe10Cr با جلادهی مکانیکی بیشتر بود. تحلیل کمی لایه اکسید بر روی آلیاژ Fe10Cr پس از جلادهی مکانیکی، ترکیبی با 16% اکسید کروم را نشان داد که نشان می دهد آلیاژ زیر لایه محافظ دارای ترکیب اسمی است.
جلادهی مکانیکی و غرقاب نمودن در محلول قلیایی با pH 13
طیف های XPS پس از غرقاب نمودن در محلول قلیایی با pH 13 تغییر کردند: سیگنال آهن فلزی کاهش زیادی یافت که نشانگر صخامت بیشتر لایه محافظ است و مقدار بیشینه پیک اکسید آهن به سمت انرژی های پیوند بیشتر، جابجا گردید . تحلیل دقیق تر پس از برازش منحنی به طیف p3/22Fe از آلیاژ Fe10Cr با جلادهی مکانیکی پس از غرقاب نمدن به مدت 20 ساعت در pH 13 نشان داد که شدت جزء Fe(II) در eV8/708 به میزان قابل توجهی کاهش یافته بود (تا زیر 10%) و همچنین بخ شعمده موجود در آن زمان، ناشی از جزء مربوط یه اکسید Fe(III) بوده است.
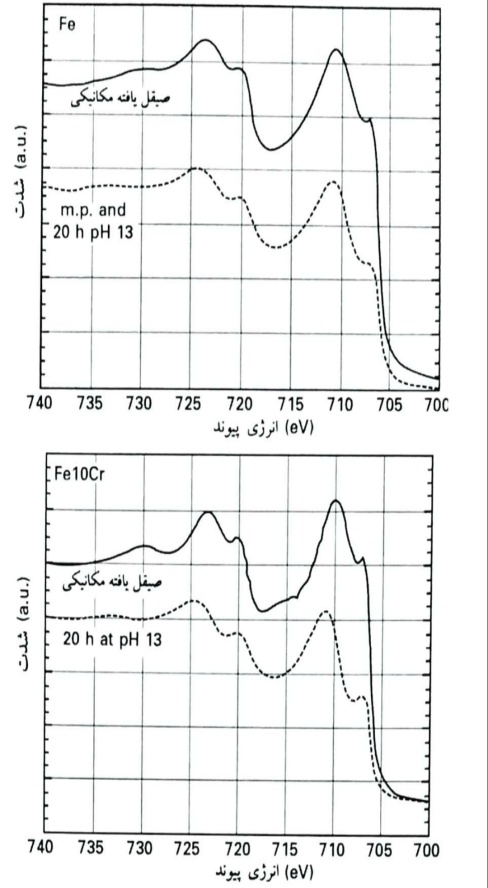
طیف های XPS آهن Fe2p ثبت شده برای نمونه های آهن (نمودار بالا) و Fe10Cr (نمودار پایین) پس از جلادهی مکانیکی و به دنبال آن غرقاب نمودن به مدت 20 ساعت در محلول هوازدایی شده NaOH در pH 13
تعیین پیک ها، موقعیت و FWHM هر یک از ترکیبات آهن p3/22Fe در لایه های سطحی اکسید شده از آلیاژهای Fe10Cr و آهن
| Assignment |
موقعیت (eV) KE |
انرژی پیوند (eV) |
FWHM (eV) |
توضیحات |
| فلز آهنی |
0.1 ± 799.9 |
706.7 |
1.3 |
Exp 0.63 |
| اکسید آهن (II) |
777.80 |
708.8 |
2.6 |
G/L*=0.45 |
| اکسید آهن (III) |
776.30 |
710.3 |
2.6 |
G/L*=0.45 |
| آهن (III) اکسی هیدروکسید |
774.50 |
712.1 |
3.0 |
G/L*=0.45 |
| *Gaussian/lorentzian |
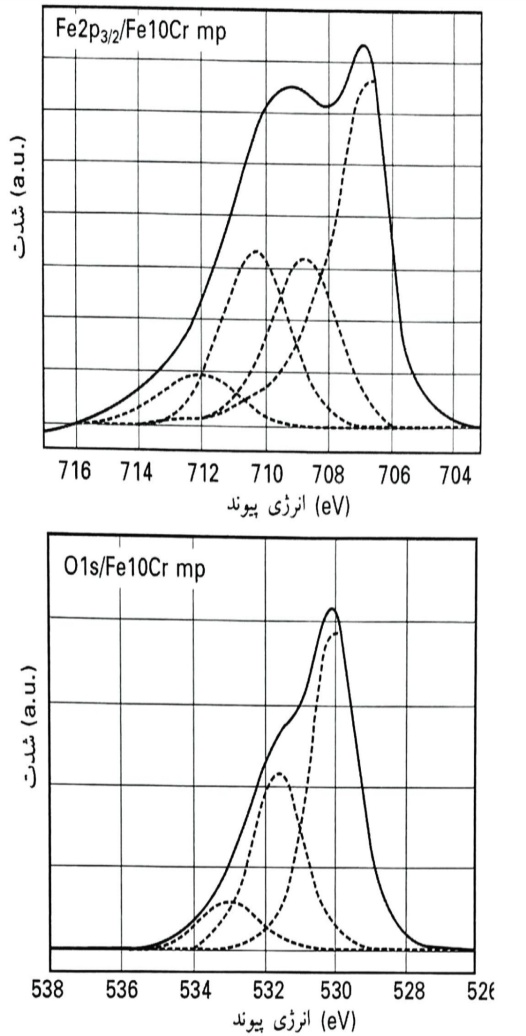
طیف های p3/22Fe و s1O از آلیاژ Fe10Cr با جلادهی مکانیکی پس از حذف پس زمینه و برازش منحنی
ضخامت و ترکیب لایه اکسید و ترکیب آلیاژ زیر لایه آلیاژ Fe10Cr با جلادهی مکانیکی با زمان های غرقاب مختلف در محلول های قلیایی هوازدایی شده با pH 13
| زمان |
ضخامت (nm) |
فیلم اکسید |
آلیاژ زیر فیلم |
| % Fe |
% Cr |
% Fe |
% Cr |
| براق شده مکانیکی |
2.0 |
84 |
16 |
90 |
10 |
| 16 ساعت |
2.6 |
75 |
25 |
91 |
9 |
| 25 ساعت |
2.6 |
66 |
34 |
93 |
7 |
| 3 روز |
6 |
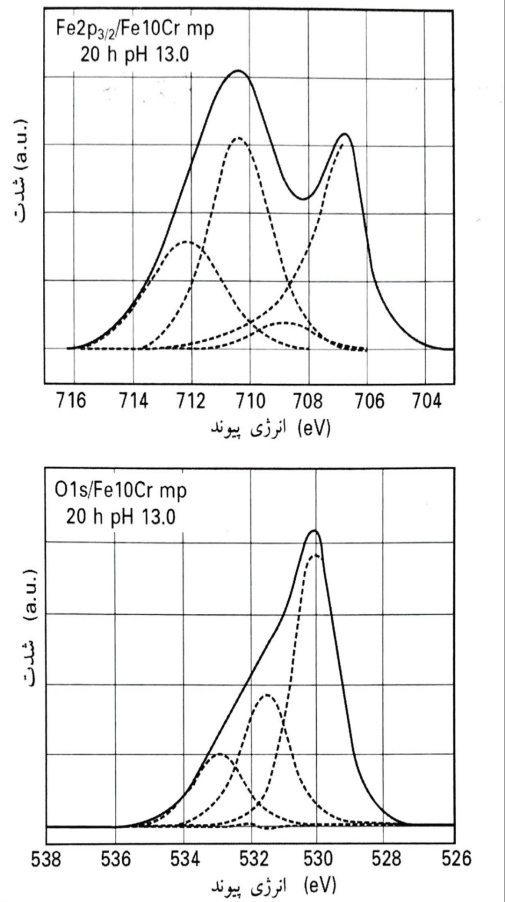
طیف های p3/22Fe و O1s از آلیاژ Fe10Cr با جلادهی مکانیکی و غرقاب شده به مدت 20 ساعت در pH 13 پس از حذف پس زمینه و برازش منحنی
روندی مشابه برای آهن خالص با جلادهی مکانیکی پس از غرقاب شدن در pH 13 اتفاق افتاد، با این تفاوت که کاهش جزء Fe(II) چندان قابل توجه نبود و جزء Fe(II) در مقدار تقریبی 20% باقی ماند. طیف های اکسیژن O1s، آهن و آلیاژ Fe10Cr پس از غرقاب نمودن، بسیار شبیه یکدیگر بودند. ترکیب لایه اکسید و بخش زیر لایه اکسید به همراه ضخامت لایه اکسید، با استفاده از شدت های پیک اجزاء مختلف مورد ارزیابی قرار گرفت و مدل سه لایه با موفقیت در نمونه های دیگر به کار گرفته شد. نتایج تحلیل کمی آلیاژ Fe10Cr، افزایشی را در مقدار کروم در لایه اکسید، از 10% تا 25% پس از 16 ساعت غرقاب نمودن، نشانمی دهد. غرقاب نمودن طولانی مدت آلیاژ Fe10Cr تا 3 روز، منجر به ترکیبی از لایه اکسید با مقدار تقریبی Cr 35% گردید که نشانگر افزایش قابل توجه اکسید کروم است به طور موازی، غرقاب نمودن طولانی مدت منجر به کاهش شدید مقدار کروم در آلیاژ زیر لایه اکسید شد .
جلادهی مکانیکی و قرارگیری در معرض هوا (35% rh)
یکسری از آزمایشات به منظور مطالعات اثر قرارگیری در معرض هوا بر ترکیبات لایه سطحی، صورت گرفت. طیف های p3/22Fe و O1s به مواد تشکیل دهنده خود، همانگونه که قبلا بیان شد، تجزیه شدند و شدت های (درصد) نسبی سیگنال های آهن اکسید شده Fe(II)، Fe(III) و FeOOH تعیین گردید. همانگونه که قابل مشاهده است، اثر اصلی قرارگیری طولانی مدت در معرض هوای خشک تا 20 روز، تغییری در ترکیب لایه سطحی ایجاد ننمود. با این وجود ضخامت لایه پس از 20 روز، از nm 8/1 به nm 4/2 افزایش یافت .
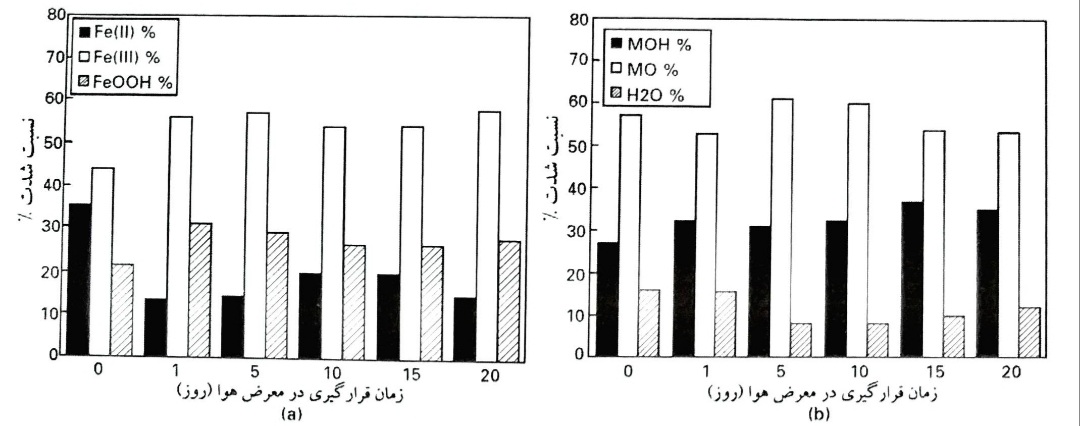
اثر مدت زمان قرارگیری در معرض هوا بر ترکیب لایه تشکیل شده بر روی آهن خالص (a) ترکیبات آهن و (b) ترکیبات اکسیژن
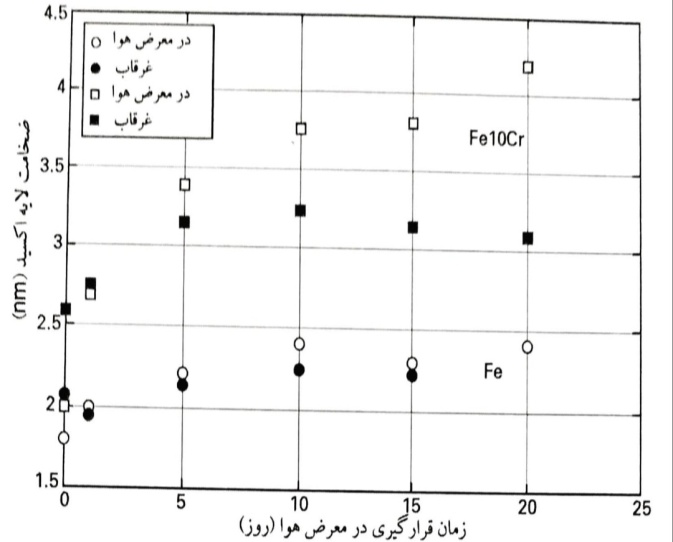
ضخامت لایه اکسید آلیاژهای Fe10Cr و آهن با جلادهی مکانیکی پس از قرارگیری در معرض هوا و سپس غرقاب نمودن برای مدت 20 ساعت در محلول با pH 13
شدت نسبی سیگنال اکسیژن O1s برای زمان های مختلف قرارگیری در معرض هوا، یک تغییر تدریجی تر را نشان می دهد: درصد جزء در بیشترین انرژی پیوند (حدود eV335) با زمان کاهش می یابد، درحالی که هیدروکسید (در انرژی پیوند حدود eV 8/531) به طور جزئی افزایش می یابد.
روند کلی آلیاژهای Fe10Cr مشابه روند آهن است، اما این نکته درخور توجه است که شدت های Fe(II) از ابتدای قرارگیری در معرض هوا، کمتر بوده اند. همین موضوع برای جزء اکسیژن در eV 533 نیز برقرار است. ضخامت لایه اکسید تشکیل شده بر روی آلیاژهای Fe10Cr، پس از قرارگیری در معرض هوا به مدت 20 روز، از 2 تا mm 4 افزایش می یابد . مشخص گردید که لایه نازک اکسید تشکیل شده پس از جلادهی مکانیکی، به طور متوسط حاوی 16% کروم اکسید شده بوده است. پس از قرارگیری در معرض هوا از 1 تا 20 روز، این مقدار روی ترکیب اسمی 1±10% کروم اکسید شده، ثابت ماند.
اکسید شدن در هوا و غرقاب نمودن در محلول های قلیایی
نمونه های آهن خالص و آلیاژ Fe10Cr قرار گرفته در معرض هوا، سپس برای مدت 20 ساعت در محلول قلیایی با pH 13 غرقاب شدند. طیف های p3/22eF و O1s همانگونه که قبلا بیان گردید، به اجزاء تشکیل دهنده خود تجزیه شدند و شدت های نسبی سیگنال های آهن اکسید شده، Fe(II)، Fe(III) و FeOOH تعیین گردید. با غرقاب نمودن آلیاژهای Fe10Cr قرار گرفته در معرض هوا، بخشی از لایه اکسید تشکیل شده در هوا حل شد و پس از 20 ساعت غرقاب شدن، لایه ای به ضخامت nm 2/0±3 حاصل گردید. به موازات کاهش ضخامت لایه، مقدار کروم اکسید شده در لایه از 10% به 20% افزایش یافت . بیشترین افزایش در مقدار کروم، برای نمونه هایی با مدت طولانی قرارگیری در معرض هوا و در نتیجه ضخامت زیاد لایه، به دست آمد .
ضخامت و ترکیب لایه اکسید و ترکیب آلیاژ زیر لایه برای آلیاژهای Fe10Cr با جلادهی مکانیکی و قرار گرفته در معرض هوا برای زمان های مختلف و سپس غرقاب شده به مدت 20 ساعت در محلول های قلیایی هوازدایی شده با pH 13
| زمان |
ضخامت (nm) |
فیلم اکسید |
آلیاژ زیر فیلم |
| Fe% |
Cr% |
Fe% |
Cr% |
| در معرض هوا |
تصاویر در مقاله |
90 ± 1 |
10 ± 1 |
92 ± 1 |
8 ± 1 |
| 1 روز |
8/2 |
88 |
12 |
92 |
8 |
| 5 روز |
2/3 |
88 |
12 |
92 |
8 |
| 10 روز |
3/3 |
88 |
12 |
93 |
7 |
| 15 روز |
2/3 |
84 |
16 |
92 |
8 |
| 20 روز |
1/3 |
79 |
21 |
90 |
10 |
لایه های اکسید تشکیل شده در هوا
پس از جلادهی مکانیکی در اتانول، یک لایه اکسید بسیار نازک (nm 1/0±9/1) حاوی تا 50% Fe(II) بر روی سطح آهن و آلیاژ Fe10Cr تشکیل می گردد. پس از قرارگیری در معرض هوای خشک، این لایه بیشتر اکسید شده و مقدار یون های Fe(II) در لایه تا حدود 15% افت کرده و متناظر با آن، مقدار Fr(III) در لایه افزایش می یابد. این مطلب با نتایجی که برای سطح آهن کف دار قرار گرفته در معرض اکسیژن یا هوا به دست آمده است، سازگار می باشد. توجه به این نکته جالب است که تنها 24 ساعت قرارگیری در معرض هوا، برای انجام این واکنش اکسایش کافی بوده و قرارگیری بیشتر در معرض هوا تا 20 روز، نسبت Fe(II)/Fe(III) در لایه برای هر دو مورد آهن و آلیاژ Fe10Cr راب ه میزان قابل توجهی تغییر نمی دهد. در عوض، تغییراتی در ضخامت لایه قابل تشخیص است : ضخامت لایه اکسید بر روی آهن خالص، از nm 1/0±9/1 برای نمونه جلادهی مکانیکی به nm 1/0±4/2 پس از 20 روز افزایش یافت. برای آلیاژ Fe10Cr، افزایش ضخامت لایه برجسته تر بود ؛ ترکیب لایه اکسید، نزدیک به ترکیب اسمی (Cr 1±10%) آلیاژ بود. بنابراین، حضور کروم در آلیاژ، شکل گیری اکسید تشکیل شده در هوا را تسریع می نماید. رسم نتایج ضخامت لایه در برابر لگاریتم t (t= زمان قرارگیری در معرض هوا)، خط مستقیمی را نتیجه می دهد که بیانگر یک رابطه توانی برای رشد لایه است.
5-4-2- پتانسیل های خوردگی
پتانسیل خوردگی فولاد مسلح سازی مقاوم در سازه بتنی، اساسا توسط واکنش کاهش اکسیژن کاتدی و در نتیجه توسط pH محلول حفره ای و موجود بودن اکسیژن تعیین می گردد؛ پتانسیل های خوردگی در محدده V(SCE) 15/0- تا صفر برای سازه های در معرض هوا، مشاهده می شوند. در این مطالعه آزمایشگاهی، کار با سطوح مشخص با جلادهی مکانیکی، اثر حالت سطح پیش غرقاب نمودن (جلادهی مکانیکی و قرارگیری در معرض هوا9 و شرایط آلیاژ با 10% کروم، مورد بررسی قرار گرفته است. همانگونه که مشخص است، در حضور اکسیژن، پتانسیل های مثبت تری هم برای آهن و هم برای آلیاژ Fe10Cr به دست می آید که با نتایج مربوط به فولاد در بتن، سازگار هستند. در عین حال که نمونه های تازه جلادهی شدهف پتانسیل های خوردگی اولیه بسیار منفی در حدود V(SCE) 6/0- را نشان می دهند، نمونه هایی که به مدت چند روز در معرض هوا قرار گرفته اند، پتانسیل های خوردگی اولیه مثبت تری را در محلول هوازدایی شده، ناشی از حضور لایه اکسید تشکیل شده در هوا، نشان می دهند.
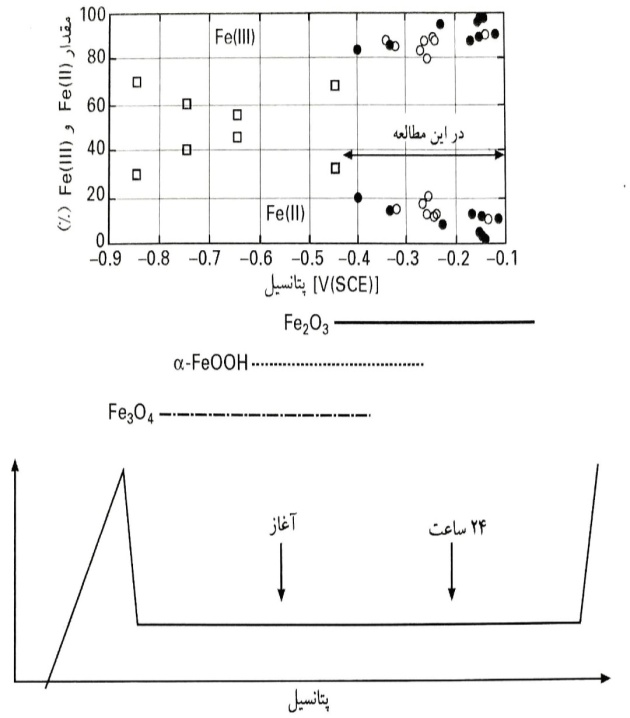
این رفتار، با ترکیب داده های الکتروشیمیایی با اطلاعات تحلیل سطح، به طور منطقی قابل توضیح است. چنانکه توسط هاپت و همکاران مشخص شده است، در یک مطالعه آزمایشگاهی بر روی آهن کف دار (بدون اکسید) قرار گرفته در معرض محلول های قلیایی با pH 13، نسبت Fe(II)/Fe(III) در لایه اکسید، به پتانسیل الکتروشیمیایی تشکیل لایه بستگی دارد : در پتانسیل های بسیار منفی، کمتر از V(SCE) 9/0-، تنها گونه های Fe(II) در لایه اکسید یافت می شوند، درحالی که در پتانسیل های مثبت تر در حدود V 1/0-، لایه ها تنها شامل 10% Fe(II) هستند. در این مطالعه، لایه های اکسید بر روی آهن و آلیاژهای Fe10Cr به طور طبیعی در پتانسیل اتصال باز (بدون قطبش آندی) در محلول های قلیایی، تشکیل شدند، با ترسیم درصد اکسیدهای Fe(II) و Fe(III) به دست آمده در لایه سطحی، که در این مطالعه توسط تحلیل XPS صورت پذیرفت، در برابر مقدار نهایی پتانسیل اتصال باز ،روند روشنی قابل مشاهده است : با افزایش پتانسیل اتصال باز، درصد Fe(II) رو به کاهش می رود.
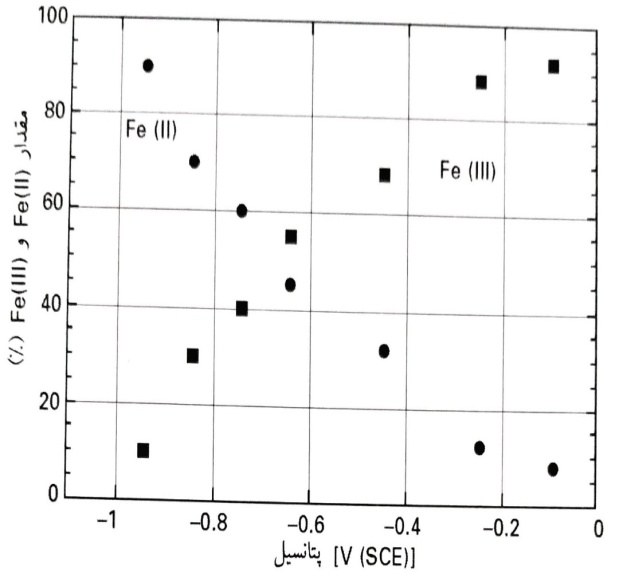
تغییر مقدار Fe(II) و Fe(III) در لایه محافظ بر روی آهن قرار گرفته در معرض محلول با pH 13،
با پتانسیل تشکیل لایه
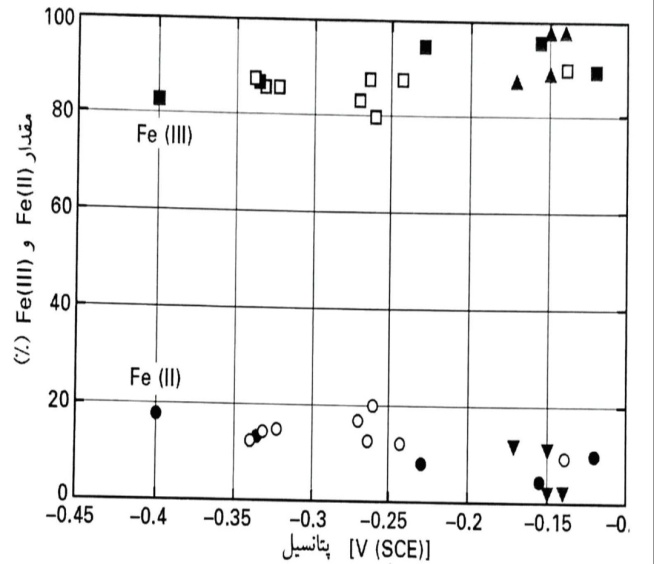
پتانسیل اتصال باز و مقدار Fe(II) و Fe(III) در لایه های سطحی پس از قرارگیری آهن، آلیاژهای Fe10Cr و اکسیدهای توده ای در معرض محلول با pH13
برخلاف ناحیه محدود مقادیر OCP (V SCE1/0- >E> 4/0-)، تغییرات مشاهده شده حدودا بین 20% و 5% قرار دارند که با نتایج تحلیلی اولیه سطح با XPS، نتایج طیف سنجی برجا رامان، و اکسیدهای توده ای غرقاب شده در محلول های قلیایی با pH مشابه، تطابق خوبی دارند.
آلیاژ Fe10Cr روندی مشابه آهن خالص را دنبال می کند، با این تفاوت که مقدار Fe(II) در پتانسیل اتصال باز یکسان به میزان جزئی پایین تر است. برای تایید و تصدیق بیشتر، نمونه های آهن تازه جلادهی شده، با غرقاب شدن در محلول قلیایی با pH 13، پتانسیل های بسیار منفی را نشان دادند.
درصد Fe(II) در لایه سطحی که توسط تحلیل XPS تعیین گردید، در حدود 50% بود که با نتایج موجود در مراجع برای پتانسیل تشکیل لایه که V(SCE) 6/0- است، تطابق خوبی دارد. بنابراین، لایه سطحی اولیه که از نظر Fe(II) غنی است، در محلول های قلیایی اکسید شده و پتانسیل اتصال باز در تطابق با افزایش مقدار Fe(II)، افزایش می یابد. در عوض، لایه های تشکیل شده در هوا، مقادیر اولیه پتانسیل اتصال باز در حدود V(SCE) 3/0- را نشان می دهند که ناشی از مقدار بسیار کمتر Fe(II) در حدود 15% هستند.
رشد لایه و تجزیه آن
داده های XPS مربوط به آهن و آلیاژ Fe10Cr با جلادهی مکانیکی نشان می دهند که غرقاب نمودن نمونه های با جلادهی مکانیکی در محلول قلیایی برای مدت 20 سات، منجر به افزایش در ضخامت لایه اکسید به اندازه nm 2/0 برای آهن خالص و nm 5/0 برای آلیاژ Fe10Cr می گردد .
هر دو ماده دارای حالت مقاوم بوده و رشد لایه همراه با افزایش پتانسیل اتصال باز خواهد بود . این مطلب توسط آزمایشات اخیر با ترکیب اندازه گیری های حفاظت پتانسیواستاتیکی و ریزتوازن کریستال کوارتز (QCM) بر روی آهن با جلادهی مکانیکی در محلول های قلیایی با pH 13، تایید شده است: در محدوده پتانسیل از V 4/0- تا صفر، یک افزایش جرم جزئی در مدت 1 ساعت از قطبش، مشاهده می گردد. در مورد آلیاژ Fe10Cr، این افزایش جرم برجسته تر بود. رشد ضخامت لایه در این مطالعه مشاهده گردید و افزایش جرم همراه با یک جابجایی در پتانسیل الکترود به سمت مقادیر مثبت تر، از طریق تبدیل لایه از مگنتیت [Fe3O4, %50 Fe(II)] به Fe2O3 (فقط Fe(III)) قابل توضیح است که توسط طیف سنجی برجا رامان و با توجه به رابطه زیر مشخص می شود:
(5-1) 2Fe3O4 +2OH- =3Fe2O3 +H2O+2e-
این واکنش برگشت پذیر است، بنابراین می تواند در رشد لایه در مسیر آندی و در تجزیه لایه در مسیر کاتدی، شرکت نماید. در مسیر اکسایش، این واکنش با جذب 1 اتم اکسیژن به داخل شبکه 2 همراه خواهد بود.
در سطوح اکسید شده رد هوا، پس از 20 ساعت غرقاب نمودن در محلول قلیایی با pH 13، کاهشی در ضخامت لایه اکسید مشاهده گردید . این کاهش برای آهن خالص قابل صرف نظر بود اما برای آلیاژهای Fe10Cr به مقدار nm 5/0 رسید. در طول این فرآیند، پتانسیل اتصال باز ثابت باقی ماند یا تنها به طور جزئی افزایش یافت ، بنابراین ضخامت ثابت لایه برای آهن خالص، با واکنش تبدیل لایه که بیشتر مورد بحث قرار گرفت، سازگار ااست. برای آلیاژهای Fe10Cr، واکنش های بیشتری باید اتفاق بیفتد که در درجه اول مربوط به تغییر حالت ظرفیتی آهن نیستند. همانگونه که از جداول می توان دریافت، غرقاب شدن لایه های اکسید تشکیل شده در هوا در آلیاژهای Fe10Cr، منجر به افزایشی در مقدار کروم اکسید شده در لایه شده و در نتیجه جزء آهن لایه کسید ترجیحا حل می گردد.
به طور خلاصه، از نتایج به دست آمده از این مطالعه تحلیلی سطح با XPS به همراه نتایج حاصل از مراجع دیگر ، یک تصویر نسبتا مناسبی از سطح آهن در محیط های قلیایی به دست می آید : در پتانسیل های پایین، با استفاده از هر دو روش XPS برجا یک طرفه و طیف سنجی برجا رامان، اساسا مگنتیت، Fe3O4]نسبت Fe(II) به Fe(III) برابر 1:1[، به دست می آید.
با افزایش پتانسیل (یا به صورت پتانسیواستاتیکی تحمیلی یا از طریق غرقاب نمودن طبیعی در پتانسیل اتصال باز)، لایه اکسید ضخیم شده و به طور تدریجی به a-FeOOH و Fe2O3 تبدیل شده، چنانکه توسط طیف سنجی برجا رامان مشخص شده است و مقدار Fe(II) عملا ناپدید می گردد .
کاربرد فولاد در بتن
علاوه بر وقوع چرخه های طبیعی تر و خشک شدن، روش های ترمیم الکتروشیمیایی بر پتانسیل فولاد در بتن، تاثیرگذار است. طی مدت حذف لکتروشیمیایی کلرید یا قلیایی نمودن مجدد الکتروشیمیایی، فولاد به پتانسیل های بسیار منفی قطبیده می شود. مثلا پس از قطع جریان در یک آزمایش قلیایی نمودن محدود، پتانسیل های حدود 1/1- تا v(sce) 8/0- اندازه گیری شده است.
خلاصه ای شماتیک از نتایج الکتروشیمیایی و تحلیل سطح برای آهن و آلیاژ Fe10Cr در محلول های قلیایی. تصویر بالا: نسبت Fe(II)/Fe(III)، تصویر وسط: اکسیدهای آهن شناسایی شده توسط طیف سنجی رامان، تصویر پایین: منحنی قطبش با OCP اولیه و نهایی از نمونه های با جلادهی مکانیکی
با استفاده از اندازه گیری های پتانسیل نیم پیل به عنوان یک روش تشخیصی برای موفقیت روش های ترمیم الکتروشیمیایی، این پتانسیل های منفی ممکن است به جای حالت مربوط به آرماتورهای با حفاظت مجدد، به اشتباه به عنوان یک حالت خوردگی تفسیر شوند. نتایج به دست آمده از تحلیل سطح صورت گرفته در این مطالعه، احتمال انجام چنین تفسیری را به حداقل می رساند: پتانسیل های بسیار منفی در طول مدت ترمیم الکتروشیمیایی، موجب تغییر ترکیب لایه اکسید به Fe(II) به طور عمده شده و زمان طولانی مورد نیاز (در عمل معادل چندین هفته) برای رسیدن به یک پتانسیل پایدار و مثبت تر برای فولاد در بتن، ناشی از اکسایش مجدد به Fe(III) است.
پرسش مربوط به فولاد از پیش زنگ زده در داخل ملات یا بتن، در این مطالعه مورد بررسی قرار نگرفته است، چرا که آماده سازی سطوح آهن و Fe10Cr از طریق جلادهی مکانیکی یا قرارگیری در معرض هوای خشک انجام شده است. در مورد خوردگی موضععی که در غیر از سطح مقاوم فولاد روی می دهد، کاهش Fe(III) در Fe2O3 به Fe(II) و Fe3O4 ممکن است یک واکنش کاهش اضافی موازی با کاهش اکسیژن باشد، چنانکه برای خوردگی در هوا پیشنهاد شده است، ممکناست نرخ خوردگی را افزایش داده یا یک واکنش خوردگی در غیاب اکسیژن را تقویت نماید. مقدار جریان کاتدی در این منبع، توسط مقدار یون های Fr(III) موجود رد لایه اکسید و درنتیجه توسط ضخامت لایه اکسید یا زنگ تعیین می گردد. یک برآورد تقریبی نشان می دهد که یک لایه (ضخیم) زنگ به اندازه µm1 با mC cm-2 600-300 متناظر خواهد بود و در نتیجه یک جریان کاهش کاتدی به اندازه حدود µA cm-21 برای چندین روز ممکن است تولید شود (بدون در نظر گرفتن تاخیر جنبشی احتمالی). در این زمینه، مطالعات بیشتری مورد نیاز است.
در زمان انجام اندازه گیری های الکتروشیمیایی (مثلا مقاومت قطبش، طیف سنجی مقاومت ظاهری و روش های پالس)، که معمولا با قطبش نمونه با mV 20± در پتانسیل اتصال باز همراه است، تغییر ظرفیت شیمیایی در لایه اکسید آهن (اکسایش، کاهش) ممکن است یک گردش جریان ناشی از کوپل redox (ترجمه) Fe(II)/Fe(III) را تولید نماید. این جریان کوپل redox می تواند منجر به یک ثابت زمانی فرکانس پایین در طیف های مقاومت ظاهری (شبه ظرفیت خازنی) شده و مقادیر به دست آمده از نرخ خوردگی را تحت تاثیر قرار دهد، اما بزرگی این جریان شارژ کننده هنوز شناخته نشده است. به کمک نتایج حاصل از تحلیل سطح در این مطالعه، انتظار نمی رود که یک تغییر پتانسیل کوچک معادل mV 20±، نسبت را تحت تاثیر قرار دهد.
قطبش آندی (منحنی قطبش، ولتامتری چرخه ای) منجر به یک اکسایش اضافی لایه شده که در نتیجه ضخیم شدن لایه و تنها حضور Fe(III) را می توان انتظار داشت. در طی چرخه معکوس ولتامتری، یک بخش اضافی در منحنی های کاتدی مشاهده می شود که می تواند ناشی ااز تجزیه لایه و واکنش کاهشی باشد.
مقاومت خوردگی آهن خالص و آلیاژهای Fe10Cr در این مطالعه مورد بررسی قرار نگرفته اند. با این وجود، نتایج این مطالعه تحلیل سطح، امکان تفسیر برخی نتایج موجود در مراجع را فراهم می آورد. مشخص شده است که سالخوردگی لایه محافظ آهن خالص یا فولاد نرم، مقاومت در برابر حمله حفره حفره شونده را از طریق افزایش پتانسیل حفره حفره شونده، بهبود بخشیده و تاثیر کاهش کاتدی اکسیژن را کمتر می کند. نشان داده شده است که سالخوردگی، پتانسیل حفره حفره شدن فولاد در محلول های قلیایی را به میزان زیادی تحت تاثیر قرار داده و همچنین ممکن است بر «مقدار بحرانی کلرید» نیز اثر بگذارد. این موضوع از طریق رشد لایه و به طور همزمان کاهش مقدار Fe(II) در لایه محافظ، قابل توضیح است که منجر به یک لایه محافظ با آسیب پذیری کمتر از نظر الکترونیکی، می گردد. بهبود مقاومت خوردگی فولادهای کروم در بتن و در نتیجه مقدار کلرید بحرانی بسیار بالاتر از آنها برای تخریب لایه محافظ، ممکن است از طریق غنی شدن قابل ملاحظه لایه محافظ از اکسید کروم که در این مطالعه مشخص گردید، قابل توضیح باشد.
نتیجه
نتایج مربوط به یک مطالعه الکتروشیمیایی و تحلیل سطح با XPS بر روی سیستم های شبیه سازی آهن و آلیاژ Fe10Cr در محلول NaOH با pH 13 نشان می دهد که این سیستم ها محیط حفره ای بتن را شبیه سازی نموده اند. به عنوان یک نقطه شروع، نمونه های آهن و Fe10Cr پس از جلادهی مکانیکی در اتانول، مورد مطالعه و بررسی قرار گرفتند. نتایج XPS نشان می دهد که یک لایه نازک اکسی هیدروکسید وجود داشته و حالت اکسایش آهن اساسا Fe(II) است. سپس این نمونه های با جلادهی مکانیکی در معرض شرایطی به منظور شبیه سازی شرایط محیطی قرار گرفتند.
بلافاصله پس از غرقاب نمودن در محلول های قلیایی با pH 13، مقادیر OCP بسیار منفی ثبت گردید. تداوم غرقاب نمودن، منجر به یک روند افزایش مجانبی و مقادیر OCP مثبت تر گردید. مقادیر OCP به ترکیب آلیاژ و درجه هوادهی (حضور یا غیاب اکسیژن) محلول، بستگی دارند. تحلیل سطح با XPS نشان می دهد که لایه سطحی پس از غرقاب نمودن طولانی مدت آلیاژ Fe10Cr، مقدارم کروم اکسید شده در لایه محافظ، به 35% تا 40% می رسد.
نمونه های قرار گرفته در معرض هوا (رطوبت نسبی 35%) برای یک مدت طولانی (تا 20 روز)، اکسایش پیش رونده لایه سطحی و تغییر تدریجی Fe(II) را نشان دادند. مقدار اکسید کروم در آلیاژ Fe10Cr در ترکیب اسمی 1±10% ثابت ماند. پس از غرقاب نمودن این نمونه های اکسید شده در محلول های قلیایی، OCP اولیه بسیار مثبت تر از مقادیر متناظر نمونه های با جلادهی مکانیکی بود.
غرقاب نمودن نمونه های اکسید شده در هوا در محلول های قلیایی با pH 13، منجر به ایجاد تغییر ساختاری در لایه اکسید گردید. به ویژه برای آلیاژ Fe10Cr، ضخامت لایه اکسید کاهش یافت و پس از گذشت 20 ساعت از غرقاب نمودن مقدار اکسید کروم به 20% رسید.
با استفاده از نتایج این مطالعه، امکان ایجاد رابطه میان رفتار الکتروشیمیایی آهن و آلیاژ Fe10Cr در محلول های قلیایی با ساختار شیمیایی سطح لایه های اکسید، فراهم می گردد. می توان نتیجه گرفت که مقدار پتانسیل اتصال باز (OCP) در محلول های قلیایی، به شدت با درصد Fe(II) و Fe(III) در لایه مربوط بوده و مقادیر مثبت تر OCP، به مقدار بیشتر Fe(III) در لایه مربوط است.