فرآیندهای خوردگی فلزی به طور عام و زنگ زدن فولاد به طور خاص، ماهیتا الکتروشیمیایی هستند. بنابراین مستلزم وجود یک الکترولیت می باشند که معمولا محلولی است آبی که وقوع واکنش های آندی و کاتدی را امکان پذیر نموده و امکان حرکت یون ها بین محل های آند و کاتد بر روی سطح فلز را فراهم می آورد. این مکانیزم که شامل انتقال یون ها در داخل الکترولیت به شکل «جریان های خوردگی» می باشد، در شکل 5-3 برای آهن و فولاد در حال خورده شدن در یک محیط آبی با مقدار pH تقریبا خنثی در حضور اکسیژن محلول، نشان داده شده است.

زنگ زدن فولاد در بتن
در این حال، محصولات محلول اولیه فرآیندهای آندی و کاتدی (یون های Fe+2 و OH-)، واکنش های بیشتری را با اکسیژن و آب انجام داده و رسوب قهوه ای رنگ با چسبندگی کم از اکسید آهن هیدراته شده به نام «زنگ» را تشکیل می دهند که دارای ترکیب متغیری می باشد (نسبت به FeOOH). اطلاعات بیشتر درباره ماهیت و تئوری فرآیندهای خوردگی فلزی به طور عام را می توان در بسیاری از کتاب های درسی مربوطه مانند فونتانا، 1986 و جونز، 1992 به دست آورد.
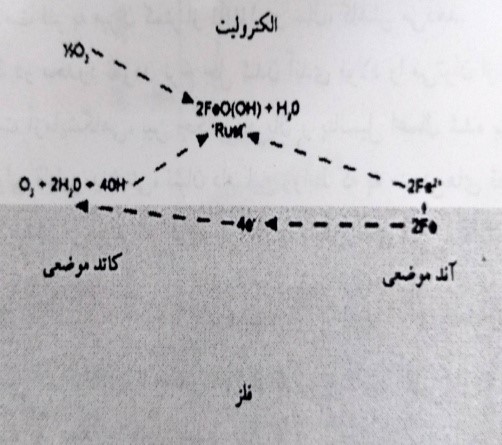
شکل 5-3- مکانیزم الکتروشیمیایی تشکیل زنگ
از آنجا که زنگ آهن، حجم جامد بسیار بیشتری نسبت به آهنی که از آن تشکیل یافته را اشغال می نماید، در صورتی که فرآیند خوردگی با نرخ قابل ملاحظه ای در داخل فاز الکترولیتی اتفاق بیافتد که در خلل و فرج ماده متراکم و تردی مانند بتن وجود دارد، تشکیل زنگ آهن می تواند تنش های کششی به میزان کافی بزرگی را ایجاد نموده و منجر به ترک خوردگی و خورد شدن بتن گردد. این پدیده در نهایت می تواند منجر به تخریبی از نوع نشان داده شده در شکل های 5-1 و 5-2 گردد، که نشان دهنده خروج سازه های مورد نظر از حالت کارایی و خدمت پذیری می باشد. برای سازه های بتن مسلح، نشانه های مشهود خوردگی (لکه های زنگ زدگی یا ترک خوردگی) معمولا پیش از ایجاد خطر بالای گسیختگی سازه ای، قابل مشاهده می باشند، اگرچه در هنگام انجام ارزیابی شرایط، این خطر هرگز نباید نادیده انگاشته شود. اما برای سازه های بتنی پیش تنیده، خطرات گسیختگی ناگهانی، بسیار مهم می باشد.

زنگ زدن فولاد در بتن و راهکارها
ایجاد لایه محافظ
این حقیقت که خوردگی زیاد فولاد معمولا در بتن متراکم اتفاق نمی افتد، در درجه اول ناشی از خاصیت قلیایی سیمان می باشد. معمولا منجر به فاز مایع حفره ای سیمان سخت شده می گردد که دارای مقدار pH در محدوده 13 تا 14 می باشد که دلیل آن عبارت است از حضور NaOH و KOH حل شده. هنگامی که فولاد در معرض محلول های آبی غلیایی 5/11
تاثیر لایه محافظ در محدود نمودن نرخ حل شدن آندی فولاد را می توان از طریق مقایسه روابط تحقیق شده به صورت آزمایشگاهی، بین چگالی جریان و پتانسیل اعمال شده برای آندهای فولادی در محلول های معمولی قلیایی و خنثی، نشان داد. این روابط که به منحنی های قطبش آندی معروف هستند نشان می دهند که اگرچه در اغلب محلول های آبی pH برابر با 7 یا کمتر، نرخ واکنش آندی:
Fe Fe+2+(-e)
با بالا رفتن پتانسیل آند فولادی تا محدوده ای به اندازه چند صد میلی ولت، به طور نمایی افزایش می یابد، اما این پدیده به اصطلاح «حل شدن فعال» در محلول های آبی با 5/11 < PH مشاهده نمی گردد. در عوض، آغاز تشدید لایه م��افظ با یک افت شدید در چگالی جریان آندی مشخص می شود، یعنی هنگامی که پتانسیل تا یک مقدار بحرانی افزایش می یابد (تقریبا mV700- ، مقیاس SCE) که در آن، واکنش تشکیل لایه آغاز می گردد.
2Fe+3H2O Fe2O3+6H++6(-e)
پس از آن، با ضخیم تر شدن بسیار آهسته لایه محافظ، تغییر بسیار اندکی در چگالی جریان آندی با افزایش بیشتری در پتانیل فولاد، مشاهده می شود تا اینکه به پتانسیل بحرانی دیگر برسد که در آن تولید گاز اکسیژن از طریق تجزیه الکترولیتی آب، آغاز می گردد، یعنی رفتاری که در شکل 5-4 برای فولد در محلول هیدروکسید کلسیم اشباع بدون اضافه نمودن کلرید، مشاهده می شود (5/12~ pH). به طور آزمایشگاهی نشان داده شده است که این حالت مشخصه از منحنی قطبش آندی که به معنی امکان تشکیل لایه محافظ فلز می باشد، هم برای آندی های فولادی در محلول های قلیایی و هم برای آنهایی که در خمیرهای سیمانی سخت شده قرار دارند، به کار می رود، برای مثال مراجعه کنید به پیج و ترداوی.
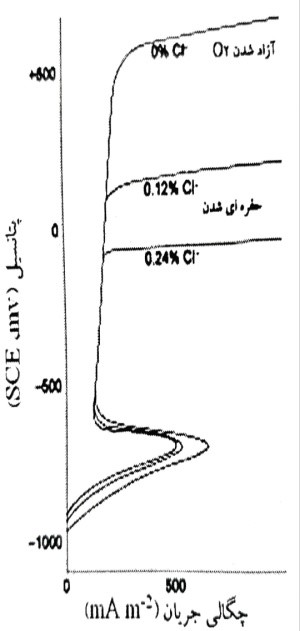
شکل 5-4- منحنی های معمول قطبش آندی پوتانسیودینامیکی برای فولاد نرم در محلول اشباع
هیدروکسید کلسیم با غلظت های مختلف کلرید افزوده شده.