در مورد خوردگی در محلول های قلیایی و ملات سیمان تحقیقاتی توسط تیم پژوهشی کلینیک بتن انجام شده که میتواند تاثیر بسیار زیادی در مقاوم سازی سازه ها داشته باشد. با توجه به نمودار پورباایکس ، انتظار می رود که روی در pH> 10.5با تشکیل یون های زینکات هیدروژن(HZn)خورده شود. در pH بتن در محدوده بین 5/12 تا 13 قلیایی قرار دارد. اگرچه اغلب آب حفره ای دارای pH بالاتر از مقدار معمول قابل تحمل برای روی است، اما رفتار آرماتور فولادی با پوشش روی در بتن معمولا خوب است. آرماتور فولادی گالوانیزه در موقعیت هایی که در آنها فولاد بر اثر کلرید یا کربناسیون خورده می شود، با موفقیت مورد استفاده قرار می گیرد. با این وجود، نرخ خوردگی محلول های به شدت قلیایی هوادهی شده برای اغلب کاربردهای عملی، بسیار بالا است. در نتیجه، این موضوع چندان مورد توجه قرار نگرفته است. بوکریس و همکاران واکنش های کاتدی و آندی را در حضور سطوح نسبتا بالای یون های زینکات توصیف نموده اند که در آن شیب های تافل، جریان تبادل و مکانیزم انحلال و ته نشینی موضوعات اصلی هستند. تخریب لایه محافظ بر اثر کلرید و حفره ای شدن به طور دقیق توسط گو و همکاران مورد بررسی قرار گرفته است. رفتار آندی در حدود pH مشابه آنچه در کار حاضر مورد نظر است، توسط آگوستینسکی و همکاران و در محلول های قلیایی با غلظت بیشتر توسط باخ و همکاران توضیح داده شده است. مجموعه کلینیک بتن ایران، آزمایش هایی با روی در محلول های KOH، آب حفره ای بتن و ملات سیمان به طور مصنوعی که یکی از ترمیم کننده های بتن است را توضیح می دهد که شامل مطالعات برخی پدیده های منتخب از طریق ولت سنجی چرخه ای و طیف سنجی مقاومت ظاهری الکتروشیمیایی (EIS) است.
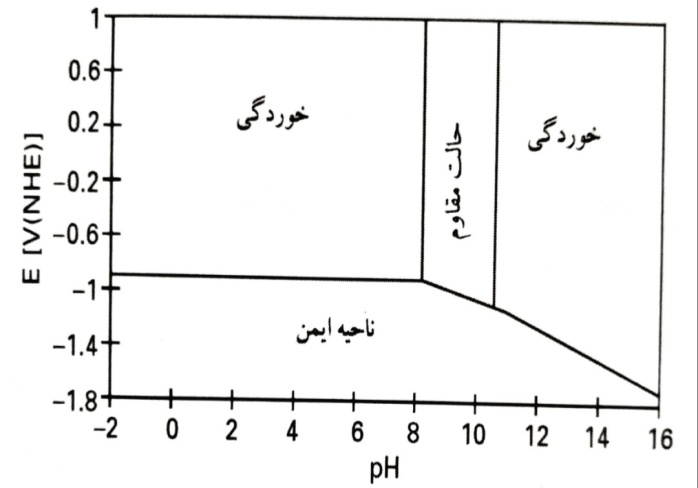
نمودار ساده شده pH احتمالی برای روی
روش های آزمایشگاهی
آزمایش های استاتیکی خوردگی در محفظه های شیشه ای 5/0 لیتری در معرض هوا صورت پذیرفت. شرایط آزمایش به طور خلاصه به همراه نتایج ارائه می گردد. پیج و نسلند دریافته اند که آب حفره ای در بتن جدید می تواند شامل 0.2M KOH -0.1M NaOH اشباع شده با Ca(OH)2 باشد. محلول های آزمایش حاضر حاوی KOH و NaOH در کف محفظه های آزمایش قرار داده شد. مواد شیمیایی از درجه تحلیلی بودند. الکترودهای مورد استفاده برای آزمایش های الکتروشیمیایی در هر دو محلول و در ملات سیمان از جنس روی با درجه خلوص بالا به شکل صفحات دایره ای به قطر mm6 بودند که با اپوکسی در خلا روکش شده بودند تا یک سطح کاری دایره ای صاف به مساحت cm 25/0 ایجاد گردد. سطح مورد نظر از طریق سایش با کاغذ سمباده و به دنبال آن تمیزکاری با HCI به اندازه wt %5/0، آماده سازی گردید. آزمایش های الکتروشیمیایی در محلول ها، در بطری های دربسته 6/0 لیتری با روزنه ای برای ورود الکترودکاری، الکترود مرجع و الکترود شمارنده AISI316، و یک آهن ربای همزن به همراه تولید حباب های هوا در داخل محلول ها، انجام گرفت. الکترودهای مشابه روی در داخل استوانه های ملات سیمان به قطر حدود cm8 و ارتفاع cm15 قرار گرفتند. ماسه و سیمان پرتلند با نسبت 1:3 (سه به یک) و با نسبت اب به سیمان 6/0 مخلوط شدند. یک دال با NaCI با مقدار کلرید 1% وزن سیمان مخلوط گردید.
دال های ملات سیمان برای 10 روز اول با آب پوشیده شدند و پس از آن در هوای با رطوبت نسبی 95% در یک ظرف فولادی ضد زنگ در دماهای C° 2±22 نگهداری شدند. پاسخ به سطوح رطوبتی مختلف مورد توجه قرار گرفت. بنابراین، پس از 130 روز قرارگیری در معرض شرایط مورد نظر، ملات با آب اشباع گردید. پس از آن دال ها برای یک دوره 200 روزه خشک تر شدند و سپس دوباره مرطوب گردیدند.
الکترودهای روی در ملات سیمان، با الکترودهای مرجع داخلی از جنس مس با فواصل mm3 همراه بودند. دال های ملات سیمان همچنین دارای الکترودهای شمارنده به صورت سیم مسی در پیرامون آنها بودند. این حالت، اندازه گیری های الکتروشیمیایی را با جریان اعمالی بهبود بخشید، زیرا این اندازه گیری ها بدون مرطوب نمودن سطح قابل انجام بودند. پتانسیل های الکترودهای مسی مرجع و پتانسیل های خوردگی الکترودهای روی در فواصل مشخص با یک الکترود کالومل دارای تماس با سطح ملات سیمان از طریق یک تکه کاغذ مرطوب کوچک، اندازه گیری شدند. از آنجا که الکترودهای روی گاهی اوقات دارای مقاومت قطبش در محدوده MΩ می باشند، یک مولتی متر عادی، جریان بسیار زیادی را خواهد کشید. یک الکترومتر با خطای pA10 استفاده شد. طیف سنجی مقاومت ظاهری الکتروشیمیایی با یک دستگاه EIS900Gamry انج��م گرفت. یک گالوانواستات و پتانسیواستات Gamry CMS 100 که با رایانه کنترل می شد، برای اندازه گیری های دیگر مورد استفاده قرار گرفت.
خوردگی استاتیکی
نمونه هایی با مساحت سطح cm215 در محفظه های شیشه ای 5/0 لیتری آزاد در برابر هوا تحت شرایط استاتیکی در معرض خوردگی قرار گرفتند. محصول خوردگی هنگامی که غلظت هیدروکسیل به M 03/0 و بالاتر رسید، حل گردید. دوره ای با یک پتانسیل خوردگی تقریبا ثابت و نرخ خوردگی ثابت، اندکی پس از شروع قرارگیری در معرض شرایط، اتفاق افتاد. افت وزن پس از 18 ساعت قرارگیری در معرض شرایط، برای تمام موارد قرارگیری در هیدروکسیل M 03/0 تا M1 (pH 5/12 تا 9/13) یکسان بوده و متناظر با نرخ خوردگی تقریبا ثابت و نرخ خوردگی 0.4mm y-1 بود.
پتانسیل خوردگی و مقاومت ظاهری قطبش خطی (LPR) از طریق تماس نمونه ها با یک سوزن از جنس روی به قطر حدود mm1 اندازه گیری گردید. پس از قرارگیری در معرض شرایط به مدت 3 تا 9 ساعت و مستقل از pH, LPR در حدود Ωcm2400 بود. هم زدن آرام محلول ها و حتی کار با محفظه های آزمایش بر روی میز، منجر به لرزش هایی می شد که پتانسیل خوردگی را کاهش می داد. بنابراین، نرخ های خوردگی عموما کاربردی نیستند، اما برای شرایط و هندسه آزمایش در آزمایشگاه دارای کاربرد می باشند. محلول ها در این آزمایش ها جایگزین نشده و به زودی حاوی سطوح بالایی از یون های زینکات هیدروژن شدند. پس از 10 روز، نمونه های قرار گرفته در معرض هیدروکسیل با غلظت های M 1/0 و کمتر، دارای یک لایه نازک خوردگی سفید شدند و وزن آنها افزوده گردید. از آنجا که لایه نازک خوردگی، سطح را به طورکامل محافظت نکرده بود، حفره ای شدن اتفاق افتاده بود. محصول خوردگی هنگام حل شدن در اسیدف CO2 آزاد نمود که ثابت کننده حضور کربنات روی است. فرض می شود که CO2 هوا، Ca+2 موجود در محلول ها را حذف کرده است، برخلاف Ca(OH)2 جامد که در کف محفظه های آزمایش به جا مانده بود. این آزمایش ها جنبه های جالب توجهی را آشکار نمود. با این وجود، از آنجا که CO2 در بتن غیر کربناته وجود ندارد، جزئیات مربوط به آن در این گزارش تشریح نشده است.
قرارگیری در معرض محلول هایی با هوای بدون CO2
هوای آزمایشگاه پیش از آنکه به طور پیوسته به داخل محلول های آزمایش موجود در محفظه های شیشه ای دربسته وارد گردد، از میان یک جداساز Ca+2 دوگانه عبور داده شد. پتانسیل خوردگی را به صورت تابعی از زمان در pH برابر 13 در یک محلول اشباع Ca(OH)2 (شامل 10-3MCa+2)، نشان می دهد. ملاحظه می گردد که یک جهش ناگهانی به سمت پتانسیل خوردگی بالاتر در غیاب یک جریان اعمالی، اتفاق افتاده است. پیش از این گام، LPR بین 20 تا Ωcm230 تغییر کرده است. پس از این گام، LPR بین 600 تا Ωcm-2800 تغییر کرده است که نشانگر یک تغییر از خوردگی فعال (محرک) به غیرفعال (مقاوم) است. برای تعیین LPR، یک جریان آندی ثابت کوچک برای یک دوره کوتاه اعمال شد و تغییر پتانسیل با یک الکترومتر اندازه گیری گردید. برای اجتناب از دست خوردگی الکترود، از جریان هایی استفاده شد که تغییرات پتانسیلی تنها در حدود mV 5 ایجاد می کردند.
با توجه به نمودار پورباایکس در حالت مقاوم (لایه محافظ) در pH 13 انتظار نمی رود. یون های کلسیم ممکن است این فرآیند را از طریق تشکیل زینکات کلسیم تحت تاثیر قرار دهند. برای بررسی این موضوع، آزمایش هایی در غلظت 0.1M KOH صورت گرفت. تغییر از حالت محرک به مقاوم همچین در این مورد اتفاق افتاد، اما به نظر می رسید که این تغییر نیازمند زمان طولانی تری باشد. هرگونه اثر کلسیم بر پتانسیل خوردگی و LPR در حالت محرک و همچنین حالت مقاوم، به سختی قابل تشخیص بود. احتمال دارد کلسیم بر خوردگی اثر بگذارد، اما این امر دلیل ایجاد حالت مقاوم نباشد. این اندازه گیری ها تحت شرایط آشفتگی (تحریک) انجام شده است. نرخ خوردگی در حالت محرک به اندازه mmy-1 5 بوده و در نتیجه بسیار بیشتر از مقدار مورد نظر در شرایط خوردگی استاتیکی است.
نرخ بالای خوردگی منجر به آزاد شدن مقدار زیادی در محلول آزمایش گردید.
هنگام ایجاد حالت مقاوم پس از 210 دقیقه در آزمایش، همانگونه که در شکل نشان داده شده است، غلظت HZn در حدود M 03/0 بود. این امکان مورد بررسی قرار گرفت که تغییر از حالت محرک به مقاوم از طریق تجمع این محصول خوردگی آغاز شده است. برای بررسی این موضوع، آزمایش ها در محلول های استفاده شده تکرار گردید.
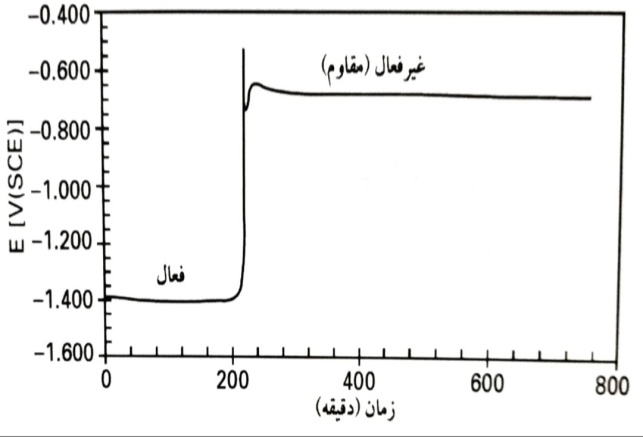
پتانسیل خوردگی به صورت تابعی از زمان در pH13 در یک محلول حاوی KOH و NaOH به نسبت 1:2 (دو به یک) و اشباع شده با Ca(OH)2 آزمایش ها در KOH در همان pH نتایج تقریبا مشابهی را نتیجه داده است.
ولتامتری چرخه ای
چگالی جریان را به صورت تابعی از پتانسیل در pH 13 نشان می دهد. اثر غلظت هیدروکسیل از 01/0 تا M 1. در مورد آخر، اندازه گیری در محلول های KOH هواگیری شده صورت گرفته است. حرکت در جهت مثبت از یک پتانسیل کاتدی جزئی آغاز شده است. از این شکل ها می توان دریافت که پتانسیل خوردگی با افزایش خاصیت قلیایی کاهش یافته و چگالی جریان در یک پتانسیل مشخص، افزایش یافته است. انحلال آندی در نواحی مختلفی اتفاق افتاده است. تا حدود mV 30 بالاتر از پتانسیل مدار باز، جریان به شدت با پتانسیل افزایش یافته است. این ناحیه با عنوان «تافل» مشخص شده است. در پتانسیل های بالاتر، جریان تا یک مقدار حداکثر مستقیم رسیده است که در این ناحیه جریان تنها اندکی متاثر از پتانسیل است. از آنجا که چگالی جریان آندی در این ناحیه با افزایش آشفتگی (تحریک) افزایش یافته است، می توان فرض نمود که انحلال آندی از طریق آزاد شدن آهسته محصولات محلول اکسیداسیون توسط انتشار و همرفت اجباری، محدود شده است. این ناحیه در با عنوان «انتشار» مشخص شده است. در پتانسیل های باز هم بالاتر، حالت مقاوم اتفاق افتاد. اما حالت مقاوم (ایجاد لایه محافظ) نرخ انحلال را تنها با یک ضریب 8 در pH 14 و با یک ضریب 5 در pH 13 کاهش داده است. در pH 12، حالت مقاوم به سختی قابل تشخیص بود. جریان آندی در ناحیه مقاوم همچنین وابسته به آشفتگی بود. یک جنبه غیر عادی این بود که نرخ اکسیداسیون مقاوم در این حالت بسیار بیشتر از مقدار متناظر برای خوردگی محرک بدون قطبش بود. مقدار حداکثر (پیک) کاتدی نشان داده شده در ، ناشی از کاهش محصولات خوردگی تشکیل شده در دوره آندی ولتامتری چرخه ای است.
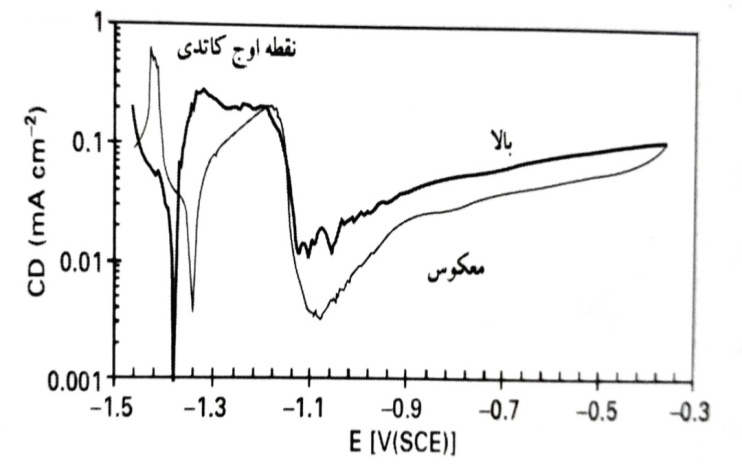
چگالی جریان به صورت تابعی از پتانسیل در pH 13. محلول مورد استفاده همان محلول مورد استفاده می باشد. نرخ حرکت (روبش) برابر 1mVs-1 می باشد. نمودارها با جبران خودکار افت پتانسیل بین الکترودهای کاری و مرجع به دست آمده اند.
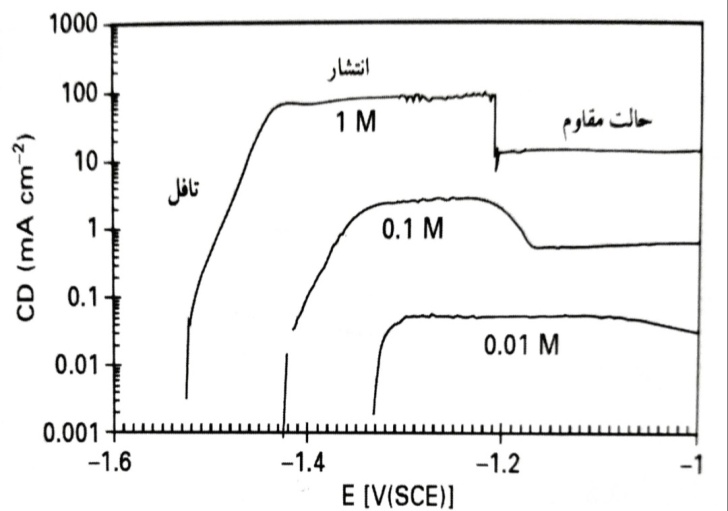
چگالی جریان به صورت تابعی از پتانسیل در KOH M 01/0 تا M 1 هواگیری شده. تنها داده های مربوط به نیم چرخه اول نشان داده شده اند. نرخ حرکت (روبش) برابر 1mVs-1 می باشد.
کلرید
خوردگی فلز روی در زندگی واقعی معمولا به میزان اندکی تحت تاثیر کلرید است. با این وجود، مشخص شده است که فلز روی مقاوم، در محلول های قلیایی تحت قطبش آندی دچار تخریب موضعی لایه محافظ . حفره ای شدن می گردد. یک مطالعه دقیق که شامل ریخت شناسی حفرات روی تک کریستال ها نیز می باشد، توسط گو و همکاران منتشر شده است. نمونه ای از کار حاضر در ارائه شده است. تحت شرایطی که در آن محصول خوردگی حل گردید، هیچگونه اثری از کلرید مشاهده نگردید. در آزمایش نشان داده شده ، تخریب موضعی لایه محافظ در حفره ای شدن در -0.46V (SCE) اتفاق افتاد که منجر به افزایش جریان تقریبا سه برابر گردید. جنبه های بسیار جالبی در حرکت معکوس نمودار مشاهده گردید. یک کاهش جریان در حرکت معکوس نمودار در حدود -0.66V (SCE) اتفاق افتاد. اما آسیب به لایه محافظ ترمیم نشد، زیرا جریان در یک پتانسیل مشخص بیشتر از مقدار پیش از وقوع تخریب لایه محافظ بود. یک جنبه شگفت آور این است که جریان کاتدی حتی بالاتر نیز بود. اینگونه به نظر می رسد که پدیده تخریب لایه محافظ با فعالیت کاتدی و آندی بسیار بالا، نقص هایی را ایجاد نموده است. این نشان می دهد که روی فعال در محلول، «بدون پوشش» نیست، به گونه ای که در این صورت، توضیح نرخ افزایش یافته واکنش کاتدی دشوار خواهد بود.
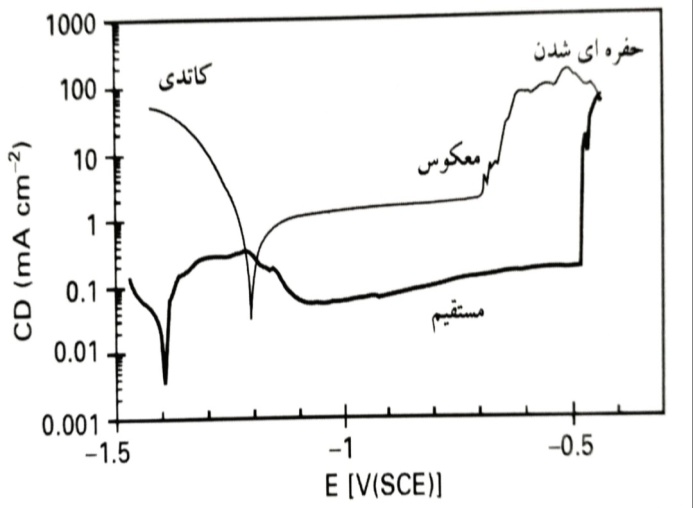
تخریب موضعی لایه محافظ در حفره ای شدن در -0.46V (SCE) باعث افزایش جریان تقریبا سه برابر شده است.
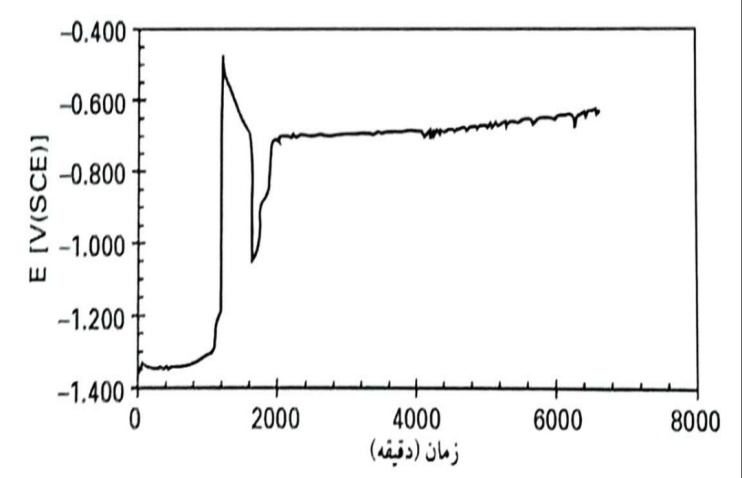
پتانسیل خوردگی بدون جریان اعمالی به صورت تابعی لز زمان در pH 13 با M NaCl 15/0 افزوده شده به محلول KOH, NaOH و Ca(OH)2
پتانسیل خوردگی را بدون جریان اعمالی به صورت تابعی از زمان در pH 13 با M NaCl 15/0 افزوده شده به محلول KOH, NaOH و Ca(OH)2 نشان می دهد. این موضوع موجب شگفتی است که کلرید از شکل گیری لایه محافظ جلوگیری نکرده است. دقیقا از آغاز ایجاد لایه محافظ، پتانسیل خوردگی برای مدت کوتاهی به همان اندازه مربوط به حالت بدون کلرید بوده است .پس از آن، یک افت ناگهانی در پتانسیل اتفاق افتاده است. فرض می شود که پتانسیل مقاوم (غیرفعال) که پس از S1500 ایجاد می شود، بیشتر از پتانسیل حفره ای شدن بوده است. بنابراین، نقص هایی شکل گرفته است. در پتانسیل کمتر پس از افت، برخی حفرات باید بهبود یافته باشند که در نتیجه پتانسیل سرانجام به نقطه ای کمی پایین تر از ناحیه مقاوم رسیده است.
برای خرید انواع پوشش های محافظتی بتن با بهترین قیمت اینجا کلیک کنید.
روی در ملات سیمان
پتانسیل خوردگی را به صورت تابعی از زمان نشان می دهند. مربوط به دو الکترود قالب گیری شده در ملات ماسه و سیمان و به ملاتی با مقدار کلرید 1% وزن سیمان مربوط می گردد. برای مطالعه پاسخ به سطح رطوبت، ملات در برخی دوره ها با آب اشباع گردید. این نواحی در بالای با علامت w مشخص شده است.
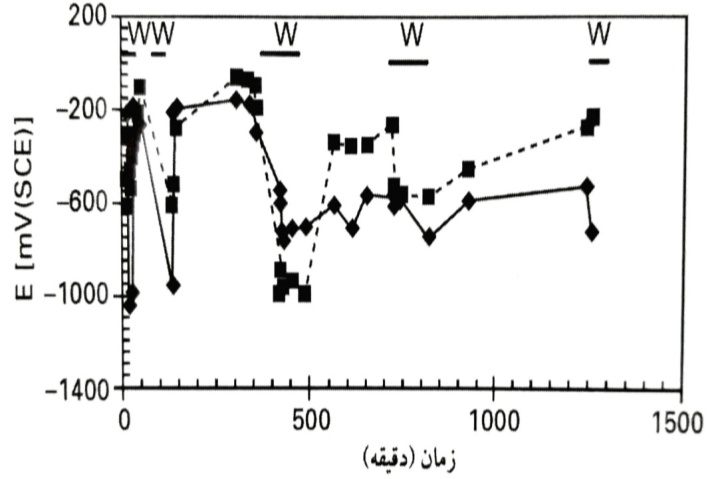
پتانسیل خوردگی به صورت تابعی از زمان برای الکترودها در ملات ماسه و سیمان. دوره های با ملات اشباع از آب با علامت w در بالای شکل مشخص شده اند.
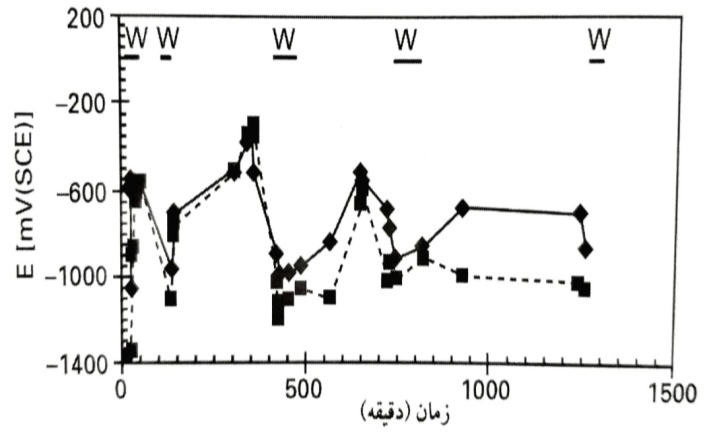
پتانسیل خوردگی به صورت تابعی از زمان برای دو الکترود در ملات با 1% کلرید دوره های با ملات اشباع از آب با علامت w در بالای شکل مشخص شده اند.
ملاحظه می گردد که سطح رطوبت، عامل بسیار مهمی بوده و منجر به پتانسیل های خوردگی پایین می گردد. چنانکه بعدا تشریح خواهد شد، این موضوع نشان دهنده نرخ های خوردگی بالا ااست. افزودن کلرید به ملات، اثر زیادی داشته و شدت خوردگی را افزایش داده است.
بدون کلرید، الکترودها به ندرت دارای پتانسیل های کمتری از -0.7V (SCE) بودند. چنانکه از مشاهده می شود، برای ملات 1% کلرید پتانسیل ها معمولا کمتر از -0.7V (SCE) بوده و بسیاری از قرائت ها کمتر از -0.9V (SCE) بودند. میانگین اندازه گیری ها با 1% کلرید تا حدود mV150 کاهش یافته است.
برخلاف شرایط محیطی در محلول های قلیایی، یک مقاومت قطبش مشخص به ندرت برای روی در ملات سیمان وجود دارد. برای روش های مختلف، مقادیر متفاوتی به دست آمده است. مقاومت قطبش به دست آمده توسط یک گام پتانسیل mV20 را نشان می دهد. مقاومت قطبش در این حالت عبارت است از نسبت بین این تغییر پتانسیل و چگالی جریان. مقادیر به دست آمده با این روش، با افزایش زمان قطبش از 10 به S100، به اندازه یک توان ده افزایش یافتند. همانگونه که خطوط در تقریبا موازی هستند، الکترود با پتانسیل خوردگی mV (SCE) 3311- صرف ظر از زمان قطبش، دارای مقادیر LPR با اندازه توان دوم ده کمتر از مقدار متناظر در mV (SCE) 15- بود. این نشان دهنده یک نرخ خوردگی بسیار بالاتر برای الکترود با کمترین پتانسیل خوردگی است.