پیشینه
به طور کلی، نرخ حمله مواد شیمیایی مهاجم به بتن ممکن است تحت تاثیر چندین فاکتور باشد که عبارتند از:
- غلظت مواد شیمیایی واکنش دهنده و سرعت های بازسازی آنها در محیط آبی اطراف بتن.
- در مورد اسیدها، غلظت یون های H+ که وسط مقاومت های آنها، یعنی ثابت های جدایش آنها (Ka)، و نیز توسط غلظت کلی اسید مورد نظر مشخص می شود. (توجه: اسیدهای معدنی مثل H2SO4 بسیار یونیزه و در نتیجه در غلظت کلی یکسان، با سرعت های بیشتری نسبت به اسیدهای ضعیف نسبتا یونیزه شده مانند اسید کربنیک، به بتن حمله می کنند).
- محصولات انحلال (Ksp) از میان محصولات واکنش و قابلیت آنها در تشکیل لایه های محافظ نامحلول.
در این مقاله که توسط کارشناسان ما در کلینیک بتن تهیه شده است، با اثرات مخرب آب، اسیدها و دیگر مواد شیمیایی مهاجم بر بتن آشنا خواهید شد.
4-6-2- شسته شدن توسط آب و اسیدها
آب خالص، آهک و تا حدی آلومینا از ترکیبات موجود در خمیر سیمان را در خود حل نموده و موجب افزایش نفوذپذیری و سرانجام رسوبی غیر متبلور از سیلیس هیدراته شده، اکسید آهن و آلومینا می گردد. این فرآیند، که به شسته شدن معروف است، شامل چندین مرحله است که در آن ابتدا پرتلندیت (CH) حل شده و سپس به C-S-H حمله می کند و هیدرات های آلومینات کلسیم ایجاد می شود. اما این انحلال به دلیل حلالیت محدود واکنش دهنده ها بسیار آهسته بوده (Ksp برای Ca(OH)2 در C°25 برابر 6-10*5/5 می باشد) و در نتیجه آسیب به بتن معمولا قابل اغماض می باشد، مگر زمانی که نفوذپذیری بتن بسیار بالا باشد و آب به طور پیوسته در آن جریان یابد. جریان آب از ایجاد حالت اشباع جلوگیری نموده و موجب می شود که مواد بیشتری به صورت واکنش نداده باقی بمانند. این حالت همچنین موجب از بین رفتن مواد نامحلول با اتصال سست می شود که این مواد ممکن است لایه محافظتی را بر روی بتن پس از حمله شیمیایی اولیه، تشکیل داده باشند. بنابراین، انحلال ادامه می یابد و در حالت های حدی ممکن است عدم یکپارچگی کامل اتفاق بیفتد.
در سازه های قرار گرفته در معرض فشار هیدرواستاتیکی قابل ملاحظه، نرخ ورود سیال افزایش می یابد مانند سدها، لوله های بتنی جدار نازک و مجاری عبور آب، و اثر مخرب نیز ممکن است شدت یابد. مشکلات شسته شدن ناشی از عمل حل کنندگی آب نسبتا خالص، در برخی سدهای ناحیه اسکاندیناوی که با بتن متخلخل ساخته شده بودند، گزارش شده است. در صورتی که لوله ها به جای آنکه فقط در داخل رس واقع باشند، در ماسه یا رس ماسه دار قرار گیرند، آسیب وارده به آنها شدیدتر می شود.
 اثرات مخرب آب، اسیدها و دیگر مواد شیمیایی مهاجم بر بتن
اثرات مخرب آب، اسیدها و دیگر مواد شیمیایی مهاجم بر بتن
وجود اسیدها، سرعت تهاجم را از طریق واکنش و حل اجزاء تشکیل دهنده اصلی سیمان هیدراته شده (هیدروکسیدهای قلیایی، هیدروکسید کلسیم، هیدرات های سیلیکات کلسیم، هیدرات های آلومینات کلسیم، مونوسولفات و اترینگایت) و سنگدانه های ویژه ای مانند سنگ آهک، افزایش می دهد. در مورد مقاومت در برابر حمله اسید، کیفیت بتن مهم تر از نوع سیمان می باشد. بتن با عمل آوری خوب و تراکم مناسب با w/c پایین تا متوسط، نسبتا متراکم بوده و نفوذپذیری پایینی دارد و بنابراین نرخ ورود سیال و در نتیجه میزان حمله به بتن کاهش یافته و عموما به فرسایش سطحی محدود می گردد.
وجود سرباره های کوره ذوب آهن یا پوزولان ها در بتن ممکن است منجر به نرخ آهسته تر حمله سید گردد که از طریق کاهش نفوذپذیری و کاهش مقدار هیدروکسید کلسیم صورت می گیرد. ما به نظر نمی رسد که تفاوت های موجود میان بتن های سیمان پرتلند و بتن های شامل مقداری سیمان های سرباره ای یا پوزولانی در مقایسه با تفاوت های میان بتن های با کیفیت های مختلف، اهمیت چندانی داشته باشند. سیمان های شامل میکروسیلیس، مقداری بهبود در مقاومت نسبت به اسیدهای آلی ویژه (مثلا استیک و لاکتیک) و اسیدهای معدنی (HCI و H2SO4) را نشان داده اند. بهبود مقاومت در برابر اسیدها (استیک و لاکتیک) در انبار های علوفه تازه جریانی نیز در صورت افزودن متاکائولین به بتن سیمان پرتلند، گزارش شده است.
اگر سنگدانه های آهکی بیشتر از سنگدانه های مقاوم به اسید مورد تهاجم واقع می شوند، این پدیده گاهی اوقات می تواند مفید واقع شود، چرا که در این حالت، منبعی از کربنات فراهم می گردد که توانایی بتن در خنثی نمودن اسید را طولانی نموده و در نتیجه عمر سرویس افزایش می یابد. به علاوه، حمله اسید به بتن به صورت یکنواخت تر اتفاق می افتد، چرا که سیمان و سنگدانه هر دو تخریب می شوند. این حالت مثلا در مورد لوله های قرار گرفته د رمعرض حمله اسیدها مهم می باشد، زیرا یک سطح نسبتا صاف ایجاد می شود که نسبت به بتن ساخته شده با سنگدانه شنی، از نظر هیدرولیکی کارآمدتر می باشد که در آن حمله اسید، سطحی ناصاف ایجاد نموده و سنگدانه های برآمده و خرده های ناشی از سنگدانه های جدا شده را برجا می گذارد.
منابع عمده اسیدهایی که بر بتن تاثیر می گذارند عبارتند از: (1) آب زیرزمینی و خاک های اسیدی (سولفوریک، کربنیک، هامیک، لاکتیک)، (2) کشاورزی، مثلا خاک ها، انبارهای کود، زمین های نگهداری حیوانات (لاکتیک، بوتیریک، استیک)، (3) باران اسیدی (کربنیک، سولفوریک، نیتریک)، (4) آبروها و فرآیندهای صنعتی (هر نوعی از اسیدها)، (5) مجاری فاضلاب (سولفوریک)، (6) آب دریا (کربنیک).
تنها اسید معدنی معمول در آب زیرزمینی طبیعی، عموما در نواحی باتلاقی و لجن زارها، اسید سولفوریک می باشد. این اسید، از طریق اکسیداسیون شیمیایی و باکتریایی کانی های سولفید مانند پاپریت و مارکاسیت (FeS2) موجود در خاک یا سنگ ها و نیز در مصالح پرکننده (معمولا شیل) در مناطق ساخت و ساز، تشکیل می شود. هر مقدار اسید سولفوریک خنثی ده توسط مواد معدنی در مجاورت خاک یا سنگ ها، می تواند به بتن حمله نماید. به علاوه واکنش های انبساطی می توانند میان اسید سولفوریک و مواد معدنی در خاک اتفاق بیفتند، مثلا تشکیل سنگ گچ از کلسیت که منجر به بالاآمدگی (تورم) و در نتیجه آسیب به سازه های بتنی مجاور می گردد.
اسید سولفوریک نیز عامل خوردگی بتن در سیستم های فاضلاب می باشد که در آنها شرایط بسیار اسیدی می شود (pH< l). نمونه های بیشتری از حمله اسید سولفوریک به بتن (و همچنین دیگر اسیدهای معدنی)، در موارد استفاده آن در فرآیندهای صنعتی (که اسید می تواند به محفظه های ذخیره سازی و کف ها، حمله نماید) و ریختن، چکه کردن و انباشته سازی آن به عنوان ضایعات شیمیایی، اتفاق می افتد.
پر بازدیدترین مطالب وب سایت کلینیک بتن ایران را در این بخش دنبال نمایید
چسب بتن چیست
انواع ملات های ساختمانی شامل چه مواردی است؟
حداکثر و حداقل زمان مورد نیاز برای سفت شدن بتن چقدر است؟
در شرایط رطوبتی، اسید سولفوریک و اسید کربنیک از گارهای ضایعاتی، SO2 و CO2 تشکیل می شوند که این گازها در دودکش های نیروگاه ها و تونل های راه آهن تولید شده و می توانند موجب حمله به قسمت های بتنی سازه ها گردند. به صورت کلی تر، هوای آلوده شامل برخی گازهای اسیدی مانند SO2، NOx و CO2 می باشد که در رطوبت هوا حل شده و باران اسیدی را به وجود می آورند که اساسا شامل اسیدهای سولفوریک، نیتریک و کربنیک می باشد (pH برابر 5/4- 5/3). معمولا اثر باران اسیدی، تخریب سطوح بتنی سازه ها بوده و بنابراین اساسا ظاهر سازه را تحت تاثیر قرار می دهند.
با این وجود، نشان داده شده است که نگهداری نمونه ها در هوای غنی شده، با CO2 در حضور نمک هایی مانند نیتریت سدیم سبب تجریه شدن NOx شده و می تواند موجب تغییرات عمده ای در فرآیند عادی کربناسیون گردد. این پدیده منجر به ایجاد غلظت های بالای نیتریت و نیترات کلسیم محلول در فاز محلول حفره ای مصالح می گردد.
اسیدهای اصلی یافت شده در آب های زیرزمینی سبک (شیرین) در برخی نواحی کوهستانی یا نواحی مردابی مرتفع عبارتند از اسید کربنیک و اسید هامیک. اسید کربنیک هنگامی تشکیل می شود که CO2 در آب حل شود:
(4-8) CO2+H2O=H2CO3
مقدار کمی از CO2 (03/0%) در هوای غیرآلوده وجود دارد، اما همین مقدار موجب قوی تر شدن یک محلول بسیار رقیق اسید کربنیک (pH در حدود 7/5) می گردد. به عنوان مثال در مناطق نمزارهای زغال سنگ، مقادیر بیشتری از CO2 ناشی از تجزیه مواد آلی ممکن است در آب حل شود. هرچند که pH چندان کاهش نمی یابد، مگر آنکه اسیدهای دیگری وجود داشته باشند.
مقادیر بیشتری از اسید کربنیک می تواند به ندرت در آب حاصل از اعماق بیشتر به وجود آمده و pH را پایین تر بیاورد (تا 8/3) که این پدیده ناشی از افزایش حلالیت CO2 در فشارهای بالاتر می باشد، درحالی که سطوح اسیدی ناشی از CO2 معمولا در آب های سنگین (شامل نمک های کلسیم و منیزیم محلول) قابل ملاحظه نمی باشد.
CO2 حل شده در آب سبک (بدون نمک های محلول) برای بتن خورنده می باشد و ابتدا با هیدروکسید کلسیم واکنش داده و کربنات کلسیم نسبتا نامحلول تولید می نماید:
(4-9) Ca(OH)2+H2CO3=CaCO3+H2O
سپس محصول این واکنش، با اسید کربنیک واکنش داده و ماده نامحلول بی کربنات کلسیم (که به کربنات هیدروژن کلسیم نیز معروف می باشد) تشکیل می شود:
(4-10) CaCO3+H2CO3=Ca(HCO3)
که این حالت منجر به حل شدن مقداری از خمیر بتن می شود.
در مورد آب سخت شامل نمک های محلول، این وضعیت پیچیده تر می گردد. مثلا اسیدکربنیک موجود در آب عبوری از روی سنگ آهک، بر اثر انجام واکنش، ماده بی کربنات کلسیم تولید می نماید (مانند معادله 4-10). در این صورت، خاصیت اسیدی کاهش یافته و معمولا مقدار دی اکسید کربن آزاد در آب، قابل اغماض خواهد بود. اما اگر مقداری CO2 آزاد وجود داشته باشد، بخشی از آن در پایدار نمودن بی کربنات کلسیم شرکت نموده (مانند معادلات 4-8 و 4-10) و بقیه آن که «CO2 مهاجم» نامیده می شود، قادر به واکنش با بتن می باشد. عموما، CO2 مهاجم فقط در مقادیر قابل ملاحظه در داخل آب خالص (نرم) وجود دارد. مقدار CO2 مهاجم همچنین تحت تاثیر تعادل های شامل نمک های دیگر مانند سولفات های کلسیم و منیزیم می باشد که اغلب در آب وجود دارند.
دیگر عوامل اسیدی معمول در آب های زیرزمینی طبیعی یافت می شوند، جمعا با عنوان اسید هامیک شناخته می شوند که نشان دهنده مخلوطی پیچیده از اسیدهای ضعیف، با وزن های مولکولی از حدود 1000000 تا حدود 500 می باشد که بر اثر فساد و متلاشی شدن مواد آلی در خاک ها تولید می شوند. گاهی اوقات عبارت اسید فالویک برای بخش با وزن مولکولی پایین تر به کار برده می شود، درحالی که از عبارت اسید هامیک برای بخش با وزن مولکولی بالاتر استفاده می شود. آب اشباع شده با اسید هامیک برخلاف حلالیت پایین آن، دارای pH حدود 4 در غیاب سنگ های خنثی کننده مانند سنگ آهک می باشد. خاصیت اسیدی واقعی، با شرایط آب و هوایی و فصلی، دارای نوسان می باشد. هنگامی که اسید هامیک با بتن واکنش می دهد، مخلوطی از نمک های کلسیم تشکیل می شوند که حلالیت های آنها برحسب وزن مولکولی هر یک از اسیدها، تغییر می نماید.
اسیدهای دیگری که دارای اثر مخرب بر روی بتن می باشند عبارتند از اسیدهای آلی محلول در آب با وزن مولکولی نسبتا پایین. برای مثال، اسید لاکتیک در آب های باتلاقی یافت شده است. مقادیر زیادی از اسیدهای لاکتیک و استیک از منابع غذایی و کودی موجود در زمین های نگهداری حیوانات، تولید شده و می توانند موجب تخریب شدید بتن گردند. (در مورد زمین های نگهداری حیوانات، بسیاری از مواد مهاجم دیگر نظیر Cl-،
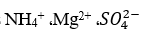 ، Mg2+، NH4+ نیز وجود دارند). دیوارهای بتنی و کف های خاکی می توانند در معرض حمله اسیدهای لاکتیک، استیک و بوتیریک که در تولید علوفه تازه تشکیل می شوند، قرار گیرند. اسید لاکتیک و بوتیریک، که در صورت ترش شدن شیر و کره تولید می شوند، موجب بروز مشکلاتی برای مخازن و کف های بتنی در تاسیسات تهیه پنیر و مواد لبنی می گردند. مشکلات مشابهی بر اثر اسید استیک در فرآیندهای تهیه سرکه و ترشیجات غذایی، و بر اثر اسید سیتریک، مالیک، تارتاریک و اکسالیک در صنایع شامل فرآوری میوه ها، ایجاد می شوند که میزان شدت حمله آنها بسته به حلالیت نمک های تشکیل شده، متفاوت می باشد.
، Mg2+، NH4+ نیز وجود دارند). دیوارهای بتنی و کف های خاکی می توانند در معرض حمله اسیدهای لاکتیک، استیک و بوتیریک که در تولید علوفه تازه تشکیل می شوند، قرار گیرند. اسید لاکتیک و بوتیریک، که در صورت ترش شدن شیر و کره تولید می شوند، موجب بروز مشکلاتی برای مخازن و کف های بتنی در تاسیسات تهیه پنیر و مواد لبنی می گردند. مشکلات مشابهی بر اثر اسید استیک در فرآیندهای تهیه سرکه و ترشیجات غذایی، و بر اثر اسید سیتریک، مالیک، تارتاریک و اکسالیک در صنایع شامل فرآوری میوه ها، ایجاد می شوند که میزان شدت حمله آنها بسته به حلالیت نمک های تشکیل شده، متفاوت می باشد.
مقاومت بسیاری از اسیدهایی که با بتن واکنش می دهند و میزان حلالیت نمک های کلسیم آنها، در جدول 4-3 نشان داده شده است.
جدول 4-3- مقاومت برخی اسیدها که با بتن واکنش می دهند و انحلال پذیری مک های کلسیم آنها
| اسید | قدرت (Ka) | محصول اصلی واکنش با سیمان |
| نام | انحلال پذیری (g/100ml) |
معدنی
سولفوریک
هیدروکلریک
نیتریک
فسفریک
کربنیک
آلی
لاکتیک
استیک
بوتیریک
سیتریک
مالیک
تارتاریک
اگزالیک
اولئیک
استریک
هومیک
(یک مخلوط) |
1- بسیار زیاد
2- 2-10×20/1
بسیار زیاد
40
1- 3-10×52/7
2- 8-10×23/6
3- 13-10×20/2
1- 7-10×5/4
2- 11-10×8/4
4-10×37/1
5-10×76/1
5-10×54/1
1- 4-10×45/7
2- 5-10×73/1
3- 7-10×02/4
1- 4-10×90/3
2- 6-10×8/7
1- 2-10×04/1
2- 5-10×55/4
1- 2-10×90/5
2- 5-10×40/6
متغیر –
کم |
سولفات کلسیم
کلرید کلسیم
نیترات کلسیم
فسفات کلسیم
کربنات هیدروژن کلسیم
کربنات کلسیم
لاکتات کلسیم
استات کلسیم
بوتیرات کلسیم
سیترات کلسیم
مالات ال-کلسیم
تارترات دی-کلسیم
اگزالات کلسیم
اولئات کلسیم
استیرات کلسیم
هومات کلسیم
|
209/0
5/74
2/121
002/0
6/16
0014/0
1/3
(7/34) 4/37
محلول
085/0
(دی هیدرات)
812/0
(تتراهیدرات)
0266/0
00067/0
04/0
004/0
متغیر |
قدرت برحسب Ka=[H+][A-]/[HA] برای تعادل HA=H++A- در محلول آبی در C°25
انحلال پذیری برحسب گرم در 100 میلی لیتر آب سرد
نمک انیدریدی مگر در مواردی که غیر از آن بیان شده باشد